Химия комплексных соединений элементов подгруппы хрома
Хром(III) относится к числу наиболее сильныхкомплексообразователей. Этому способствуют малый размер и высокий эффективный заряд иона Сг3+, что обеспечивает большую электростатическую составляющую связи Cr111—лиганд.
Cr+31s22s22p63s23p63d34s0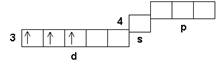
Хром способен образовывать комплексные соединения практически со всеми известными
лигандами. Однако прочность и соответственно значения констант устойчивости таких комплексных соединений изменяются в широких пределах в зависимости от донорно-акцепторной силы лигандов, их геометрии, поляризуемости.
Интересным является триоксалатохромат(III) калия К3[Сr(С2О4)3] • nН2О, который можно получить взаимодействием дихромата калия с оксалатом калия и щавелевой кислотой. Оно интересно тем, что, вследствие большого размера лигандов(представляющих собой кислотный остаток), кч Cr+3равно 3. Соединение это парамагнитно, вследствие нахождения неспаренных электронов у иона Cr+3.
Так как есть возможность перехода электронов на более энергоемкий d-подуровень, для кристаллического К3[Сr(С2О4)3] характерна окраска, а так же плеохроизм (от красного до сине-зеленого) — свойство анизотропных кристаллов проявлять различную окраску при рассмотрении их в белом свете в различных направлениях (например, в проходящем и отраженном свете).
Обычно КЧ хрома(III) в комплексных соединениях равно 6: Cs3[CrF6], Rb2[CrF5], Cs3[Cr2Cl9].
Значение эффективного магнитного момента свидетельствует о наличии трех неспаренных электронов. Уведомление мчс о монтаже как через госуслуги подать уведомление в мчс.
Огромный интерес представляют хромовые квасцы, которые также являются комплексными соединениями, но лигандами в которых выступают не сульфатные, а гидратные группы. Это было доказано после проведения рентгеноструктурного анализа твердой соли, ведь подобный анализ жидкой фазы не показал ассоциацию Cr+3с сульфат-ионами. Так, в узлах кристаллической структуры, например, KCr(SO4)2*12Н2О находятся гидратированные ионы [К(ОН2)6]+, [Cr(ОН2)6] , а также "свободные" анионы SО42-. Таким образом, роль лиганда, составляющего координационную сферу, выполняет гидратная вода: [K(OH2)6][Cr(OH2)6](SO4)2.
Хромокалиевые квасцы в лаборатории обычно получают восстановлением дихромата калия сернистым газом или спиртом в присутствии избытка серной кислоты:
K2Cr2O7 + C2H5OH + H2SO4 àKCr(SO4)2 + CH3COH + H2O
При этом надо поддерживать температуру раствора ниже 40°С. Выше 40°С раствор вместо фиолетового становится зеленым (изменяется состав внутренней сферы Сг3+), и кристаллы квасцов не образуются.
Хромовые квасцы в широком смысле слова соответствуют формуле MICr(SO4)2*12H2O(MI=Na, Rb, Cs, Tl, аммоний, гидроксид аммония, гидразиний).
Фиолетовая окраска соединений, содержащих октаэдрический гексааква-ион [Сr(ОН2)6]3+, характерна для кристаллических квасцов, например KCr(SO4)2*12Н2О, кристаллогидрата нитрата хрома Cr(NO3)3*9Н2О, сульфата Cr2(SO4)3*18H2O, одной из модификаций СrС13*6Н2О.
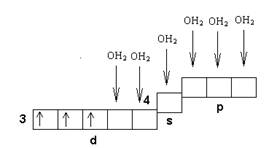
Окраска объяняется возможностью перехода е с deна dgподуровень. Также комплекс парамагнитен, вследствие неспаренных электронов. В то же время среди гидратированных солей хрома(III), как кристаллических, так и растворенных, много соединений, окрашенных в зеленый цвет. В частности, легко можно получить две разные по структуре зеленые модификации гексагидрата хлорного хрома. Если фиолетовая модификация СrС13*6Н2О содержит октаэдрический внутрисферный гексаакваион [Сr(ОН2)6] , и ионы С1- располагаются на внешней сфере, то светло-зеленая модификация имеет состав [Сr(ОН2)5С1]С12*Н2О, а темно-зеленые кристаллы — [Сr(ОН2)4С12]С1*2Н2О, т. е. внутренняя координационная сфера хрома(III) в зеленых модификациях гексагидрата хлорного хрома построена иначе, чем в фиолетовой модификации.
Такое явление называют гидратной изомерией: действительно, суммарный состав всех трех модификаций гексагидрата хлорного хрома одинаков, а строение различно. Естественно, что условия синтеза разных модификаций СгС13*6Н2О неодинаковы.
В литературе описан и четвертый гидратный изомер, содержащий все три иона С1- во внутренней координационной сфере; он имеет красную окраску и строение, отвечающее формуле [Сr(ОН2)3С13]*ЗН2О. Получить этот изомер удалось методом ионообменной хроматографии, но изучен он в значительно меньшей степени, чем остальные три изомера.
Среди комплексных соединений хрома(III) практический интерес представляет сублимирующийся при нагревании до ~200°С трисацетилацетонат Сr(АсАс)3 XXIV, содержащий три шестичленныххелатных цикла.
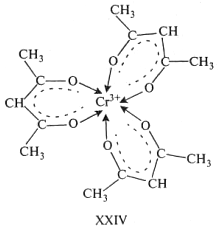
Вокруг иона Сr3+образуется координационный малоискаженный кислородный октаэдр.
Хотя химические связи хрома(III) имеют существенно ковалентный характер, летучесть трисацетилацетоната, определяется не ковалентным характером связи хрома(III) с лигандом, а слабым межмолекулярным взаимодействием в этом соединении, поскольку ионная составляющая молекулы сосредоточена в ее центре, а наружная часть молекулы является углеводородной, что и обусловливает слабость межмолекулярных контактов. Летучесть ацетилацетоната хрома(III) позволяет использовать эти соединения для газовой хроматографии и газофазного нанесения оксидных и металлических хромовых покрытий.
Комплексные соединения хрома в более высоких степенях окисления гораздо менее устойчивы и не так разнообразны, как для хрома(III). Известны фторидные комплексы Cs[CrIVF5], Cs2[CrlVF6] и Cs[CrVF6], последний очень гигроскопичен.
Комплексообразованию хрома(VI) мешают не только его сильные окислительные свойства (многие лиганды окисляются), но и то, что атом хрома(VI) обычно экранирован ковалентно связанными с ним атомами кислорода, например, в хромат-ионе СгО42- àлигандам трудно преодолеть конкуренцию кислорода, являющегося по сути одним из самых "мощных" лигандов, и вытеснить его из координационной сферы хрома.
Хром в нулевой степени окисления содержится в карбониле Сr(СО)6. Однако метод рентгеноэлектронной спектроскопии регистрирует на атоме хрома в этом соединении значительный положительный заряд, который даже выше, чем на атоме хрома в Сr2О3, [Сr(ОН2)6]С13 и в трисацетилацетонате хрома(III). Таким образом, химическая связь Cr—СО в Сr(СО)6 содержит одновременно ионный и ковалентный вклад, причем преобладает перенос электронной плотности с хрома на оксид углерода.
Другое интересное соединение хрома — дибензолхром Сr(С6Н6)2. Здесь также степень окисления хрома равна нулю. Дибензолхром относится к числу металлоорганических соединений (имеется связь металл—углерод).
Впервые это соединение было получено полвека назад взаимодействием СrС13 с реактивом Гриньяра C6H5MgBr. После кислотного гидролиза продукта получался бензольный раствор желтого цвета, из которого были выделены темно-коричневые кристаллы Сr(С6Н6)2.
Другой способ синтеза дибензолхрома — реакция безводного СгС13 с бензолом в присутствии алюминиевой пудры, которая играет роль восстановителя хрома(III) и акцептора атомов хлора из СrС13. В эту же систему вводят безводный А1С13 в качестве катализатора.
