Химия комплексных соединений элементов подгруппы хрома
H
C N O F
P S Cl
As Se Br
Sb Te I
В виде простых однозарядных ионов координируются элементы, расположенные в правом крайнем столбце, причем почти всегда в виде отрицательных ионов: K[W3+Cl1-4] Остальные донорные атомы, как правило, входят в состав координирующейся молекулы или обычно отрицательно заряженного многоатомного иона.
В зависимости от числа донорных атомов
различают лиганды с различной координационной емкостью или дентатностью ( от английского слова dentate - зубчатый), т.е. занимают около центрального атома одно, два или несколько координационных мест, соединяясь с ним посредством одного или нескольких атомов. Поэтому разные лиганды с одним и тем же комплексообразователем могут давать комплексы разного вида:
К3[Cr(СN)6]; К3[Cr(SO4)3]; где
CN– монодентатный лиганд;
SO42– - в данном случае выступает как бидентатный лиганд.
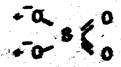
Анион же этилендиаминтетрауксусной кислоты (ЭДТК) содержит 6 донорных атомов и обладает координационной емкостью 6 и называется гексадентатным лигандом:
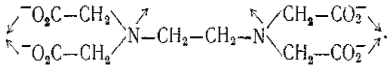
Координационные соединения, образованные полидентатными лигандами, называются циклическими, или клешневидными (хелатными).
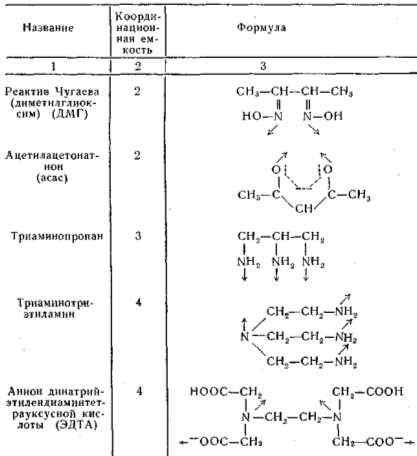
Как показал в 1906 г. Л.А. Чугаев (правило циклов), устойчивыми, заключающими наименьшее количество свободной энергии, являются координационные соединения с пяти- и шестичленными циклическими группировками, так как циклы как бы экранируют центральный атом, затрудняя обмен с окружающей средой. Способность хелатообразующих лигандов образовывать более устойчивые комплексы по сравнению с их монодентатными аналогами известна под названием хелатного эффекта, который заключается в том, что в ряду лигандов, имеющих одинаковый донорный атом, образование хелатных циклов увеличивает устойчивость комплексов. Наиболее известные хелатные лиганды приведены в табл. 1
С хелатными лигандами (некоторые из них называются комплексонами) образуют координационные соединения ионы очень многих и непереходных металлов, например, с последними двумя лигандами, приведенными в табл.1, дают очень прочные клешневидные комплексы, в частности загрязняющие природную воду ионы щелочно-земельных металлов. Поэтому эти лиганды используют и для устранения жесткости природной воды.
Амфидентатные лиганды. Некоторые лиганды могут образовывать связь с центральным атомом двумя или более способами, и они называются амфидентатными: в [Hg(SCN)4]2- связь осуществляется через атом S, то есть Hg-SCN, в [Zn(NCS)4]2- через атом N, Zn-NCS, а с Cd2+ в зависимости от условий связь может возникать и через атом серы и через атом азота, то есть [Cd(SCN)4]2- и [Cd(NCS)4]2-.
Таблица 1. Полидентатные хелатные лиганды
1.2 Номенклатура комплексных соединений
Координационные соединения вообще характерны для неорганических веществ, следовательно, вопрос способа наименования этих соединений потребовал разработки специальной номенклатуры. В настоящее время общепринятой является рациональная номенклатура, основанная на рекомендациях Международного союза по чистой и прикладной химии.
Вначале производится название аниона, затем – в родительном падеже катиона. Если соединение неэлектролитного типа, то его называют одним словом.
В названии комплексного иона в определенном порядке перечисляют все его составные части. При том вначале называют отрицательно заряженные, а затем нейтральные лиганды. Нейтральный лиганд называют так же, как и молекулу ( H2O - аква, NH3 – амин, NH2CH3 - метиламин, CO – карбонил), а к латинскому названию лигандов-анионов добавляют суффикс 0 ( Cl- - хлоро, CN- - циано, H- - гидро, O2- - оксо, OH- - гидроксо, SO32- - сульфито и другие ).Для координированной молекулы воды также используют суффикс 0(«акво»), аммиак NH3 обозначают термином «амин».
Перед названием одинаковы лигандов указывают их число греческими числительными: 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса, 7-гепта, 8-окса. Приставку 1-моно опускают. Название комплексного иона пишут в одно слово.
Последним называют комплексообразователь. Если он входит в состав катиона или молекулы, то ему дается русское название данного элемента. Название комплексного аниона имеет окончание «ат», которое добавляется к латинскому названию элемента-комплексообразователя. Если комплексообразователь способен проявлять несколько степеней окисления, то после его названия в скобках римской цифрой указывают его степень окисления. Вот несколько примеров:
Комплекс-катион
[Cr(NH3)6]SO4– сульфат гексаамминхрома (3)
Комплекс-анион
K[W(CN)4] – тетрациановольфрамат (3) калия
Комплекс-неэлектролит
[Cr(H2O)3F3] – трифторотриаквохром (3)
1.3 Классификация комплексных соединений
В настоящее время известно, что способность к координации присуща всем химическим элементам, поэтому координационные соединения настолько многочисленны и разнообразны по природе и строению, что трудно провести классификацию, охватывающую большинство этих соединений. Существующие системы основываются на различных принципах. Наиболее распространены следующие:
1. По знаку заряда комплекса.
В зависимости о состава внутренней сферы, комплексные соединения бывают катионного типа ( комплексный ион является катионом), анионного типа ( комплексная частица – анион) и неэлектролитного типа ( комплексная частица не несет заряда).
[Cr(NH3)6]2(SO4)3 катионный комплекс [Cr(NH3)6]3+
K[W(CN)4] анионный комплекс [W(CN)4]-
[Cr(CO)6] нейтральный комплекс [Cr(CO)6]0
2. По природе лигандов.
Если лигандами являются только молекулы аммиака или воды, то комплексы называют соответственно аммиакатами и аквакомплексами ( или гидратами).
[Cr(NH3)6]2(SO4)3, [Cr(NH3)6]Cl3 – аммиакаты
[Cr(H2O)6]Cl3, [W(H2O)6]SO4 - гидраты
Комплексы, содержащие в качестве лигандов анионы различных кислот, называют ацидокомплексами. При этом различают галогенидные, цианидные, карбонатные и другие.
Если лиганды – гидроксид-ионы (ОН-), то образуются гидроксокомплексы, проходя через стадию гидроокисей соответствующих металлов.
Комплексы со смешанными лигандами называют неоднородными.
K2[MoO(SCN)5], [WOCl3Br], Na3[Fe(CN)5SO3], K2[Cr(CO)4(CN)2]
3. По принадлежности к определенному классу соединений различают:
Комплексные кислоты - H[WCl4], H4[W(CN)8]
Комплексные основания - [Cr(NH3)6](OH)3
Комплексные соли - K2[WI4], K3[Cr(CN)6]
4. По структуре внутренней сферы комплекса:
а) Комплексные соединения могут быть простыми и циклическими.
Монодентатные лиганды образуют только простые комплексы. Полидентатные лиганды, содержащие не менее двух донорных атомов, способны к образованию циклических комплексов, которые называют клешневидными (хелатными, о них уже говорилось выше).
б) Некоторые комплексные соединения содержат не один, а два и даже больше ионов металла, являющихся центрами комплексообразования. Поэтому различают моноядерные и полиядерные комплексы.
