Химия комплексных соединений элементов подгруппы хрома
Симметрия комплекса и его стабильность в значительной мере зависят от характера заполнения электронами d-орбиталей одного и того же типа (dε и dγ). Лишь при равномерном заполнении электронами этих орбиталей электрическое поле вокруг иона-комплексообразователя будет иметь правильную симметрию. Поэтому образующиеся комплексы должны иметь форму правильных октаэдров и тетраэдров.
Все
другие электронные структуры с несимметричным распределением электронов на dε и dγ – подуровнях должны приводить к искаженным структурам, вследствие неодинакового отталкивающего действия со стороны d- электронов на лиганды.В этом проявляется эффект Яна-Теллера, являющийся следствием одноименной теоремы, согласно которой состояние системы, имеющей вырожденные энергетические (одинаковой по энергии) уровни, неустойчиво. Такие системы стабилизируются за счет дополнительных искажений, стремящихся снять вырождение и сделать один из подуровней более устойчивым (т.е. понизить энергию).
2.3.5 ТКП и оптические свойства комплексов
Спектры поглощения молекул, в том числе и комплексов, получают, пропуская свет через исследуемое вещество и устанавливая с помощью спектрографа, излучение каких длин волн поглощается.
Если вещество не поглощает фотоны (кванты света) видимой части спектра, то оно кажется на вид белым или прозрачным. Если же поглощаются фотоны всей видимой области, то вещество на вид черное. При избирательном поглощении света веществом само оно кажется окрашенным в дополнительный цвет:
|
интервалы длин волн поглощаемого света,λ нм |
Волновое число,υ, см-1 |
Цвет поглощаемого излучения |
наблюдаемый (доп. цвет) |
|
400-435 |
25000-23000 |
фиолетовый |
желто-зеленый |
|
435-480 |
23000-20800 |
синий |
желтый |
|
480-490 |
20800-20400 |
зеленовато-синий |
оранжевый |
|
490-500 | |||
|
500-560 |
20000-17900 |
зеленый |
пурпурный |
|
560-580 |
желто-зеленый |
фиолетовый | |
|
580-595 |
17900-16800 |
желтый |
синий |
|
595-605 |
16800-16500 |
оранжевый |
зеленовато-синий |
|
605-730 |
16500-13200 |
красный |
сине-зеленый |
|
730-760 |
пурпурный |
зеленый |
Комплексы переходных металлов в большинстве своем являются окрашенными соединениями, т.е. способными поглощать энергию в видимой области спектра и давать соответствующие спектры поглощения. Так, например, в спектре водного раствора соли Тi3+, содержащего гидратированные ионы [Ti(H2O)6]3+, обнаруживается область, в которой интенсивность проходящего света меньше интенсивности падающего. Эта область называется полосой поглощения и имеет максимум при λ = 560 нм, что соответствует поглощению желто-зеленых лучей спектра и обусловливает фиолетовую окраску этого комплекса.
Зная длину волны, можно рассчитать энергию поглощаемого излучения, между ними существует определенная зависимость: ▲Е=hυ=hc\λ, где h - постоянная Планка, 6.62*10-34 Дж.с-1, υ – частота излучения, λ – длина волны, с – скорость света, 3*108 м*с-1.
Спектры поглощения (а следовательно, и окраска) большинства комплексов d - элементов обусловлены переходами электронов с низших d-орбиталей на d-орбитали с более высокой энергией (d-d-переходы) при поглощении квантов света. Например, для октаэдрических комплексов - с dε - подуровня на dγ - подуровень. Такие переходы возможны, если на более высоком подуровне имеются свободные или неполностью заполненные орбитали. В таком случае комплексное соединение будет окрашено.
Разность между энергиями dε и dγ- подуровнями есть, как известно, величина ▲ - энергия расщепления d-подуровня под действием поля лигандов, причем она равна энергии поглощаемого излучения (кванта света с определенной длиной волны). Следовательно, справедливо соотношение: ▲= hс/λ.
Различие в окраске комплексов определяется значением ▲. При увеличении ▲ поглощение сдвигается в сторону высоких частот (меньших длин волн), а при уменьшении - в сторону низших частот (больших длин волн). Это значит, что при замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду левее (т.е. обладающие большей силой поля) окраска комплекса будет становиться интенсивнее.
Например:
[Cr(H2O)3(NH3)3]3+ [Cr(H2O)2(NH3)4]3+ [Cr(H2O)(NH3)5]3+ [Cr(NH3)6]3+
▲,
кДж/моль 232 241 - 258
бледно-красный оранжево-красный оранжево-желтый желтый
Таким образом, теория кристаллического поля (ТКП), также как метод валентных связей (МВС) позволяет достаточно надежно и убедительно объяснить многие важные факты химии координационных соединений: координационные числа, пространственные структуры, магнитные и оптические свойства.
3. Химия комплексных соединений элементов подгруппы хрома (на
примере некоторых соединений)
Cr, Mo и W- элементы 6-ой группы, побочной подгруппы. Это d-элементы, поэтому валентные электроны для них будут располагаться на d- и s-подуровнях. В своих соединениях они проявляют различные степени окисления, а так же координационные числа от 3 до 8( как у W), что вытекает в огромное разнообразие их комплексных соединений. Подробнее свойства некоторых комплексных соединений этих элементов в различных степенях окисления будут рассмотрены ниже.
3.1 Хром в комплексных соединениях [4]
Cr01s22s22p63s23p63d54s1Хром(II) из-за относительно малого заряда и большого размера иона Сг2+ является относительно слабым комплексообразователем. Однако он образует как катионные, так и анионные комплексные соединения.
Cr+21s22s22p63s23p63d44s0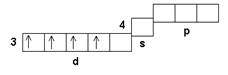
Комплексообразование хрома(II) осложняется процессами окисления с переходом хрома(II) в хром(III), поскольку комплексные соединения хрома(III) более устойчивы.
