Химия комплексных соединений элементов подгруппы хрома
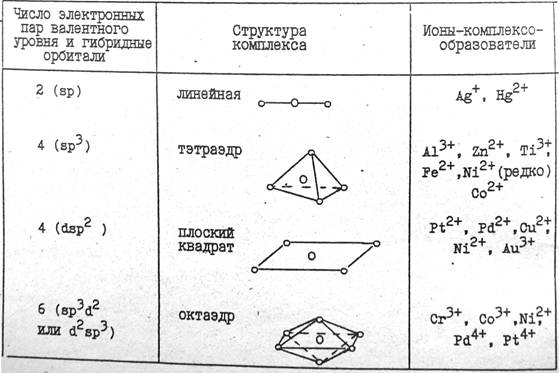
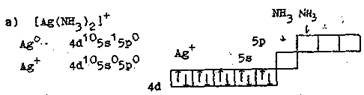
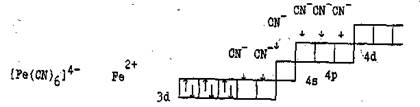
Рассмотрим строение некоторых комплексных ионов с точки зрения метода валентных связей.
|
|
|
|
Внешнеорбитальные комплексы менее устойчивы, так как степень перекрывания е-облаков при этом меньше, и связь комплексообразователя с лигандами слабее. Как следствие этого – повышенная реакционная способность комплексов этого типа по сравнению с внутриорбитальными.
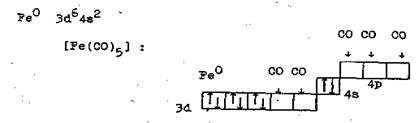
в) Метод валентных связей позволяет обосновать существование и объяснить структуру нейтральных комплексов, например, карбонилов, содержащих атомы металла в нулевой степени окисления и нейтральные молекулы СО.
|
|
Такая е-структура подтверждает, что карбонилы – диамагнитные вещества, так как не содержат неспаренных е.
Говоря об устойчивости комплексов, можно заметить, что иногда повышается устойчивость за счет образования дополнительных π-связей по дативному механизму, что возможно в случае, когда лиганд, помимо неподеленной пары е, имеет еще и свободные р- или d- орбитали, принимающие е d- орбиталей комплексообразователя.
Таким образом, основываясь на е- структуре комплексов, которую устанавливает МВС, можно делать выводы об их магнитных свойствах, реакционной способности и некоторых других характеристиках. Однако, МВС не дает ответа на многие другие вопросы, связанные со строением и свойствами комплексов. В частности, остаются неясными причины искажения правильных структур комплексов и их оптические свойства.
Ответы на эти и другие вопросы дают Теория кристаллического поля (ТКП, Бетс, 1929г.) и е современная модификация – теория поля лигандов (ТПЛ).Они являются дальнейшим развитием электростатической теории на основе квантовой и волновой механики.
2.3 Теория кристаллического поля (ТКП)
В теории кристаллического поля лиганды рассматриваются как источник создаваемого ими электростатического поля. Химическая связь между комплексообразователем и литандом считается ионной. Основное внимание уделено воздействию поля лигандов на состояние валентных d-электронов комплексообразователя. Электронные оболочки лигандов вообще не рассматриваются. Такой подход, несмотря на приближенность, пригоден для объяснения многих свойств комплексов (окраски и др.).
2.3.1 Расщепление d- орбиталей комплексообразователя под действием
поля лигандов
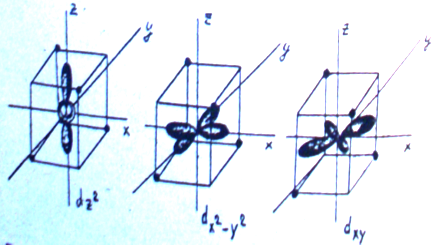
В отсутствие лигандов пять d- орбиталей комплексообразователя равноценны, т.е. имеют одинаковую энергию, но по разному ориентированы в пространстве (рис.1)
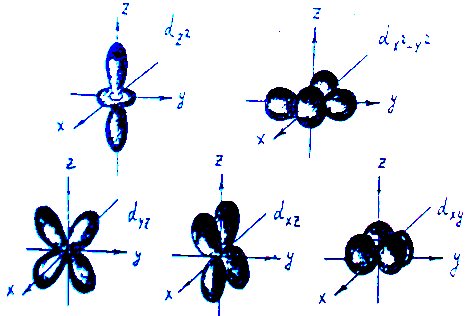
Рис 1. Формы электронных облаков d-орбиталей.
Пять орбиталей, имеющих одинаковую энергию, называют вырожденными пятикратно. Если поместить ион в центр электростатического поля лигандов, имеющих сферическую симметрию, энергия орбиталей увеличится на одну и ту же величину, т.е. d- орбитали останутся пятикратно вырожденными (см. рис. 2а).
В поле любой другой симметрии (октаэдрической, тетраэдрической и др.) произойдет расщепление d-уровня на подуровни (см. рис. 2).
Это связано с тем, что d-орбитали по-разному ориентированы в пространстве (рис.1) и поэтому испытывают неодинаковое влияние со стороны поля лигандов в зависимости от их числа и расположения в комплексе, т.е. симметрии поля (иначе - структуры комплекса).
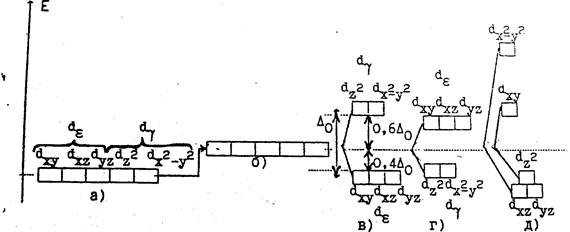
Рис.2. Расщепление d-орбиталей в полях различной симметрии:
а) в отсутствие лигандов; б) в сферическом поле лигандов; в) в октаэд-рическом поле лигандов; г) в тетраэдрическом; д) в плоскоквадратном.
Так, в октаэдрическом поле шести лигандов, расположенных в вершинах правильного октаэдра (см. рис.3), снимается вырождение d-уровня, и он расщепляется на два подуровня (см. рис.2,в).
Действительно, две из пяти d-орбиталей, a именно,dz2 и dx2-y2 направлены в сторону расположения лигандов. Отталкивание электронов на этих орбиталях от отрицательных лигандов значительнее, чем на трех оставшихся орбиталях dxy, dyz и dxz, лепестки которых направлены к ребрам октаэдра, т.е. между лигандами. Энергия электронов на первых двух орбиталях (dz2 и dx2-y2) оказывается выше, чем на трех последних (dxy, dyz и dxz ). Таким образом, исходный d-уровень расщепляется на два подуровня - более низкий, трижды вырожденный (dε) и более высокий, дважды вырожденный (dγ). Орбитали dxy, dyz и dxz называют dε, а орбитали dz2 и dx2-y2- dγ.
В тетраэдрическом поле (рис.2г) d-уровень расщепляется на подуровни dε и dγ, но расположение их обратное тому, которое наблядается в октаэдрическом поле: орбитали dz2 и dx2-y2, обладают более низкой энергией (dγ -подуровень), а орбитали dxy, dyz и dxz – более высокой (dε -подуровень). Это становится понятным из рис.4: приближенными лигандам оказываются орбитали dxy, dyz и dxz, а орбитали dz2 и dx2-y2 – более удаленными.
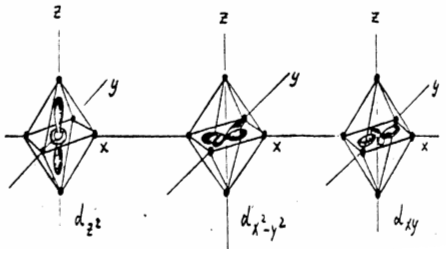
Рис.3. Ориентация d– орбиталей комплексообразователя в октаэдрическом поле лигандов.