Химия комплексных соединений элементов подгруппы хрома
Рис.4. Ориентация d– орбиталей комплексообразователя в тетраэдрическом поле лигандов.
Разницу в энергии между dε и dγ- подуровнями обозначают ▲и называют энергией расщепления. Ее можно измерять в электрон/вольтах, джоулях на моль и условных единицах.
Величина ▲ -является мерой силы кристаллического поля лигандов. Она зависит от природы комплексообразователя и лиган
дов и от симметрии поля.
Для одинаковых лигандов величина энергии расщепления в тетраэдрическом поле меньше, чем в октаэдрическом. Кроме того, если лиганды одинаковы, величина ▲ возрастает по мере увеличения заряда центрального иона. В группах периодической системы расщепление увеличивается при возрастании атомного номера элемента.
Различные лиганды, в силу особенностей своего строения, могут создавать вокруг себя "сильное" или "слабое" поле. Поэтому расщепление может быть также малым или большим. Для одного и того же комплексообразователя величина ▲ при замене лигандов убывает в следующем ряду, называемом спектрохимическим:
CO, CN─ > NO2─> NH3>NCS─>H2O>F─>OH─>C1─>Br─>I
Такие лиганды, как CO или CN─, создают сильное поле и вызывают большее расщепление, тогда как C1─ или Br─ являются слабыми лигандами, вызывая малое расщепление.
Величину энергии расщепления рассчитывают теоретическими методами или определяют экспериментально по спектрам поглощения комплексов.
Теория кристаллического поля достаточно просто и наглядно объясняет магнитные свойства комплексов. Для этого надо знать характер распределения электронов по d - орбиталям иона, находящегося в поле лигандов.
2.3.2 Магнитные свойства комплексов с точки зрения ТКП
Среди химических соединений, в том числе комплексных, различают парамагнитные и диамагнитные, по разному взаимодействующие с внешним магнитным полем. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля. Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренных электронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней.
Существуют два принципа, определяющих заполнение электронами d-орбиталей, расщепленных на dε и dγ -подуровни.
1. Электроны заполняют орбитали так, чтобы число неспаренных электронов было максимальным (правило Хунда).
2. Сначала заполняются орбитали, имеющие меньшую энергию.
С учетом этих правил при числе d-электронов в комплексообразователе от 1 до 3 или 8, 9, 10 их можно расположить по d-орбиталям только одним способом (в соответствии с правилом Хунда) (см. рис.2). При числе электронов от 4 до 7 в октаэдрическом комплексе возможно либо занятие орбиталей, уже заполненных одним электроном, либо заполнение свободных dγ –орбиталей более высокой энергии. В первом случае потребуется энергия на преодоление отталкивания между электронами, находящимися на одной и той же орбитали, во втором - для перехода на орбиталь более высокой энергии. Распределение электронов по орбиталям зависит от соотношения между величинами энергий расщепления (▲) и спаривания электронов (Р). При низких значениях ▲ («слабое поле»), величина ▲ может быть < Р, тогда электроны займут разные орбитали, а спины их будут параллельны. При этом образуются внешнеорбитальные (высокоспиновые) комплексы, характеризующиеся определенным магнитным моментом µ. Если энергия межэлектронного отталкивания меньше, чем ▲ ("сильное поле"), т.е. ▲ > Р, происходит спаривание электронов на dε -орбиталях и образование внутриорбитальных (низкоспиновых) комплексов, магнитный момент которых µ =0.
Теперь легко можно объяснить, почему, например, ион [СоF6]3─ парамагнитен, а ион [Со(NH3)6]3+- диамагнитен.
В первом случае лиганд слабого поля (ион F─) вызывает незначительное расщепление d-подуровня: ▲= 155 кДж/моль. Оно оказывается меньше энергии межэлектронного отталкивания Р = 250 кДж/моль, и поэтому шесть 3d-электронов иона Со3+ распределяются по dε и dγ -орбиталям в соответствии с правилом Хунда:
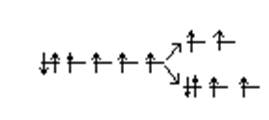
dγ
Со3+ 3d6
dε
dε 4dγ2
Таким образом, ион [СоF6]3─ содержит четыре неспаренных электрона, сообщающих ему парамагнитные свойства.
Во втором же случае, вследствие влияния лиганда сильного поля (ион CN─), энергия расщепления d – подуровня – 275кДж\моль – столь значительна, что превышает энергию межэлектронного отталкивания спаренных электронов. В этом случае энергетически более выгодно размещение всех шести 3d – электронов иона Со3+ на dε- подуровне:
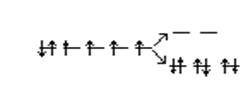 dγ
dγ
Со3+ 3d6
▲= 275 кДж/моль
Р = 250 кДж/моль
dε
dε 6dγ0
В результате в ионе [Со(NH3)6]3+ все электроны оказываются спаренными, а сам ион – диамагнитен.
2.3.3 Энергия стабилизации кристаллическим полем
В октаэдрическом поле энергия dε - орбиталей ниже, а энергия dγ – орбиталей выше той, какая она была бы у иона в кристаллическом поле сферической симметрии, где отсутствует расщепление. Поэтому при заполнении электронами dε – орбиталей система (комплекс) стабилизируется за счет выигрыша в энергии. При заполнении dγ – орбиталей комплекс дестабилизируется за счет проигрыша в энергии.
Общее понижение энергии комплексной частицы (дополнительный выигрыш в энергии) с учетом числа электронов на dε и dγ - орбиталях называют энергией стабилизации кристаллическим полем (ЭСКП). Чем больше эта величина, тем прочнее должны быть химические связи в образующемся комплексе, а значит и больше его устойчивость.
По значению ЭСКП можно судить о том, какая из пространственных конфигураций комплекса будет устойчивее.
2.3.4 О правильных и искаженных структурах комплексов
Координационные соединения могут иметь правильную или искаженную пространственную структуру. Какой будет структура комплекса, также можно предсказать на основе теории кристаллического поля.
При координационном числе, равном 6, правильной структурой считается октаэдр, а искаженной - тетрагональная бипирамида. Предельным случаем искажения при этом будет удаление двух лигандов от центрального иона и переход от октаэдра к плоско-квадратному расположению четырех остающихся лигандов (рис.5).
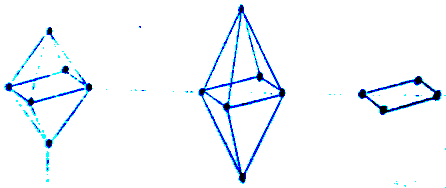
Рис.5. а) 0ктаэдр (грани равны), б) Тетрагональная (бипирамида), в) плоский квадрат (грани неравны)
Естественно, что при различных лигандах структура неизбежно будет несколько искажена. Однако искажение наблюдается и при одинаковых лигандах.
