Электроаналитические методы
Вступление
Электрохимические методы используются довольно часто, поскольку они позволяют получить богатую экспериментальную информацию о кинетике и термодинамике многих химических систем. Вследствие многообразия, высокой чувствительности и точности результатов, безынерционности, быстроте проведения анализа и возможности автоматизации электрохимические методы анализа
давно и плодотворно применяют в химии, биологии, медицине и в мониторинге объектов окружающей среды.
Все электрохимические методы анализа и исследования основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном слое. Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента и поддающийся правильному измерению, может служить аналитическим сигналом.
В соответствии с областями измерений электрохимические методы анализа делят на пять групп: потенциометрические, вольтамперометрические, кулонометрические и кондуктометрические. Инструментальный базис и теоретические основы этих методов развиты до такой степени, что они легко могут применяться даже неспециалистами. Однако в настоящее время следует отметить невосприятие электроаналитических методов теми людьми, которые не имеют опыта их применения и в недостаточной степени знакомы с электрохимией.
В работе будут рассмотрены только важные электроаналитические методы вместе с наиболее существенной информацией о возможности их применения потенциальными пользователями. В своем реферате я поставила следующие цели:
· Рассмотреть наиболее важные электроаналитические методы
· Выяснить пригодность каждого метода для определения различных ионов
· Рассмотреть достоинства и недостатки каждого метода
1. Потенциометрия
Известно, что потенциал электрода может меняться при изменении активности или концентрации одного или нескольких веществ в растворе, в который он погружен. Таким образом, измеряя потенциал можно получить количественную характеристику о составе раствора. Потенциометрические методы заключаются в измерении разности потенциалов между парой подходящих электродов, опущенных в анализируемый раствор.
Установка для измерения разности потенциалов состоит из индикаторного электрода, электрода сравнения, анализируемого раствора и потенциометра. Подключая электроды к соответствующим клеммам измерительного прибора, мы получаем возможность измерения разности потенциалов между двумя электродами или, как говорят аналитики, измеряем потенциал индикаторного электрода относительно электрода сравнения.
![]()
1.1 Индикаторные электроды
Известны два основных типа индикаторных электрода для потенциометрических измерений: металлические и мембранные электроды.
Металлические электроды можно изготавливать из различных металлов (Ag, Cu, Hg, Pb, Cd) способных давать обратимые реакции. Некоторые металлы (Al, Ni, Co, W, Cr) не могут быть использованы в качестве индикаторных, так как на их поверхности присутствуют окисные пленки либо дефекты кристаллической структуры, что приводит к получению плохо воспроизводимых потенциалов.
Мембранные индикаторные электроды бывают четырех видов:
1) электроды со стеклянными мембранами;
2) электроды с жидкими или пленочными мембранами;
3) электроды с твердыми мембранами;
4) электроды с газочувствительными мембранами.
Расчет потенциала металлических электродов
Электроды I рода (рис. 1.1) представляют собой металлическую проволоку или пластинку, опущенную в раствор соли. Пример:
![]()
![]() ;
;
![]()
![]()
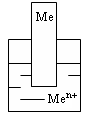
Рисунок 1.1 – Электрод I рода
Металлические индикаторы І рода используют в анализе катионов металлов, чаще всего при потенциометрическом титровании.
Электроды ІІ рода (рис. 1.2) – металлическая проволока или пластинка, находящаяся в контакте с малорастворимым соединением катиона металла и опущенная в раствор соли, содержащей анионы малорастворимого соединения.
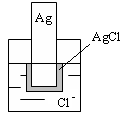
Рисунок 1.2 – Электрод ІІ рода
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Электроды ІІ рода используют в качестве индикаторных, для определения активности концентрации анионов то есть когда его используют как индикаторный.
1.2 Электроды сравнения
1) Хлоридсеребрянные электроды
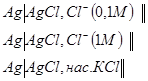
2) Каломельные электроды
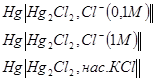
1.3 Мембранные индикаторные электроды
А) Стеклянные мембранные электроды
Оказалось, что измерить рН раствора наиболее удобно с использованием стеклянного мембранного электрода, содержащего мембрану, разделяющую два раствора с различной активностью ионов водорода.
Состав стекла, кроме основного компонента SiO2 содержит оксиды щелочных и щелочноземельных металлов, что позволяет такой мембране участвовать в равновесном объеме ионами водорода в анализируемом растворе. «Corning»: 72% SiO2, 22% CaO, 6% Na2O (H2O, K2O).
Стеклянный электрод изготавливают путем припаивания тонкого наконечника шарика из рН-чувствительного стекла к концу толстостенной стеклянной трубки заполненной раствором HCl с активностью ионов водорода равной единице (![]() ). В раствор погружают серебряную проволоку покрытую AgCl. Таким образом,
). В раствор погружают серебряную проволоку покрытую AgCl. Таким образом, ![]() - внутренний электрод сравнения. Ячейка для измерения рН содержит стеклянную рН–чувствительную мембрану, которая разделяет раствор, в который опущен электрод сравнения и внешний анализируемый раствор с опущенным внешним электродом сравнения, чаще всего хлоридсеребрянным.
- внутренний электрод сравнения. Ячейка для измерения рН содержит стеклянную рН–чувствительную мембрану, которая разделяет раствор, в который опущен электрод сравнения и внешний анализируемый раствор с опущенным внешним электродом сравнения, чаще всего хлоридсеребрянным.
Схема потенциометрической ячейки для измерения рН
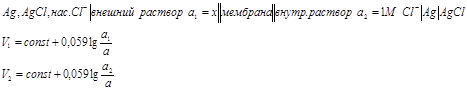
Потенциал мембраны представляет собой разность потенциалов, которая формируется на внешней и внутренней поверхности мембраны за счет ионного обмена.
