Электроаналитические методы
Если химическая реакция проходит по условному уравнению
![]()
То возможны такие случаи кривых титрования
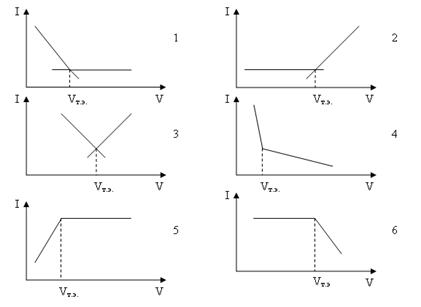
Рисунок 2.8 – Кривые титрования амперометрического титрования
1. В электродном процессе принимает участие компонент А. Точку эквивалентности опр
еделяют по части, где ток уменьшается.
2. В электродном процессе принимает участие титрант – компонент В. Точку эквивалентности определяют по части, где ток увеличивается.
3. В электродном процессе принимают участие оба компонента.
4. В электродном процессе принимают участие оба компонента, но один из них при данном напряжении окисляется, а второй – восстанавливается.
5. В электродном процессе принимает участие продукт химической реакции
6. В электродном процессе компоненты реакции участия не принимают. В раствор добавляют амперометрический индикатор – вещество, которое обуславливает наличие диффузионного тока. Индикатор берет участие в реакции с титрантом только после образования малодиссоциированного или труднорастворимого вещества элемента, который анализируют.
Выбор напряжения осуществляет по поляризационным кривым. Обычно выбранное напряжение на 0,2-0,3 В больше чем потенциал полуволны.
По полученным данным строят график в координатах «сила тока – объем титранта». Точку эквивалентности определяют путем экстраполяции линейных участков до их пересечения.
Метод амперометрического титрования применяют для всех типов химических реакций, равновесие которых определяют довольно быстро.
Концентрация титранта должна быть довольно высокой, а объем титранта в точке эквивалентности довольно малым, чтоб не происходило значительного разбавления раствора, который анализируют. Если объем титранта, использованный для титрования, большой, при построении кривых титрования необходимо учитывать разбавление раствора и вносить поправки в значение полученного тока согласно:
![]()
Где V – исходный объем раствора, который титруют, мл.
ΔV – объем добавленного титранта в любой точке, мл.
2.5 Общая характеристика метода
Вольтамперометрический метод достаточно универсален и применим к многочисленному кругу объектов. Основными достоинствами метода являются быстрота анализа, возможность определения нескольких веществ в смеси без предварительного разделения, достаточно высокая точность и применимость к анализу небольших содержаний определяемого элемента. Погрешность полярографического анализа в обычных условиях составляет ±2% для растворов концентрации порядка 10-3…10-4 моль/л и около ±5% для более разбавленных. При сочетании вольтамперометрии с методами экстракции, хроматографии и т.д. предел обнаружения снижается еще больше.
Амперометрическое титрование характеризуется более высокой точностью и более высокой чувствительностью, чем методы прямой вольтамперометрии. Аппаратурное оформление установок амперометрического титрования несложно, особенно просты установки для титрования с двумя индикаторными электродами.
3. Кулонометрия
Кулонометрические методы анализа основаны на использовании законов Фарадея для проведения количественных определений.
I закон Фарадея используется в основном в методе электрогравиметрии, который основан на определении массы выделившегося на катоде металла с определением массы электрода до и после электролиза. Электрогравиметрическое определение возможно как в гальваническом элементе (внутренний электролиз), так и в электролитической ячейке с использованием внешнего источника тока.
Электрогравиметрически на катоде определяются металлы способные количественно восстанавливаться с образованием удовлетворительных по свойствам осадков. Исключение составляют ионы свинца, которые определяют окислением Pb2+ до PbO2 осадка черного цвета.
В соответствии с I законом Фарадея масса выделившегося на катоде металла пропорциональна количеству электричества прошедшего через раствор.
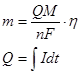
При этом необходимо учитывать выход по току η, свидетельствующий о том, что некоторое количество электричества расходуется не на выделение металла, а на ряд побочных процессов (преодоление сопротивления проводников раствора, нагревание контактных частей и т.д.)
![]()
Для более точного определения количества электричества пропущенного через ячейку с анализируемым раствором, последовательно с ней подключают кулонометр, то есть устройство, где электродный процесс протекает со 100% выходом по току. Чаще всего это серебряный кулонометр, используют также медные кулонометры, где выход по току хорошо известен.
3.1 Явления, возникающие при прохождении тока через электрохимическую ячейку
Все электрохимические методы отличаются от потенциометрии в двух отношениях:
1. Они основаны на прохождении тока через ячейку, тогда как в потенциометрических методах ток сводится к минимуму.
2. Потенциалом жидкостного соединения пренебрегают, поскольку его величина достаточно мала при использовании внешних напряжений, при прохождении тока через электрохимическую ячейку.
Необходимо учитывать три явления, которые влияют на систему.
а) Омическое падение напряжения;
б) Концентрационная поляризация;
в) Кинетическая поляризация
Омическое падение напряжения
Для прохождения тока через электрохимическую ячейку необходима движущая сила ЭДС, способная преодолеть сопротивление ионов их движению к катоду или аноду. Эта сила подчиняется закону Ома и равна силе тока в амперах на сопротивление ячейки в Омах. IR – омическое падение напряжения Омическое падение напряжения увеличивает наложенное на ячейку напряжение
![]()
Поляризационные явления
Между потенциалом и мгновенным током, который протекает через ячейку, существует линейная зависимость в соответствии с законом Ома. При высоких значениях силы тока возможно отклонение от линейной зависимости, и тогда говорят, что система поляризована и, для достижения требуемой силы тока необходимо наложить более высокое напряжение для осуществления необходимых электродных процессов.
![]()
Иногда поляризация системы может быть столь высока, что сила тока перестает зависеть от потенциала и система считается полностью поляризованной.
Поляризация – электродный процесс. Поляризованными могут быть или оба электрода или только один. Крайний случай поляризации – это идеально поляризованные электроды (РКЭ) или полностью неполяризуемые электроды (электроды сравнения).
Концентрационная поляризация
Известно, что ионы или молекулы могут перемещаться в растворе под действием трех основных сил: силы диффузии, силы электростатического напряжения, конвекционные (механические силы).
