Изучение металлургических свойств нового типа железорудного сырья (маггемитовых руд) для подготовки к доменной плавке
В результате обогащения при крупности 1-0 и 3-0 мм получено 15,6 и 17,75 % концентрата с содержанием железа 54,4 и 52,1 % железа при извлечении его в концентрат соответственно
41,8 % и 44,9 %. С учетом потерь при прокаливании содержание железа в концентрате составляет 56,1 и 54,5 %.
При повторных испытаниях на обогатимость руды рекомендованная технологическая схема предыдущей работы был
а дополнена по варианту, представленном на рисунке. Хвосты, несущие большие потери, после измельчения до 0,071 мм (60 %) были отправлены на мокрую магнитную сепарацию. Мокрая магнитная сепарация позволила дополнительно получить из хвостов 10 % концентрата с содержанием железа 54,6 % и извлечением железа 28,6 %. При этой технологической схеме показатели достигли показателей схемы гравитационно-магнитного обогащения с обжигом промпродуктов, а степень обогащения равна 2,81 против 2,25. Химический состав концентрата несколько улучшился, в %: Fe2O3 – 76,6; FeO – 0,8; SiO2 – 5,75; Al2O3 – 3,47; MgO – 5,35; CaO – 0,8; S – 0,006; P – 0,042; Cr – 1,57; Ni – 0,24; потери при прокаливании – 5,3. Основность концентрата составила ![]() = 0,66, а отношение
= 0,66, а отношение
SiO2 : Al2O3 равно 1,66. Концентрат чистый по сере (0,006 %) и фосфору (0,042 %), но содержит 1,57 % хрома. Полезная примесь – никель, содержание которого в концентрате равно 0,24 %, извлекается, к сожалению, всего 35 %, с большими потерями (65 %) в хвостах, что является закономерным, так как никель в рудах находится частью в адсорбированной форме, а частью - в виде примеси к хлоритам, где она изоморфно замещает часть атомов магния. Извлечение в концентрат хрома составляет 63 %, при этом соотношение хрома к никелю равно 6,54, что требует отнести концентрат к сильно-хромистым и ограничивает их применение. Необходимо найти пути извлечения из концентрата хрома до 0,24 % или использовать концентрат как одной из составляющих агломерационной шихты. Извлечение из концентрата хрома представляется возможным, так как большая часть хрома заключена в хромитах и хромшпинелидах с размером зёрен от сотых долей до 2 миллиметров (последние хорошо видны простым глазом в свежих штуфах руды).
Обогащение маггемитовой руды по предложенной схеме (рисунок 3,4) технологически эффективнее других рассмотренных схем, а что касается экономической эффективности, то этот вопрос о применении той или иной схемы обогащения (гравитационно-магнитной с обжигом или без обжига, магнитной, сухой или мокрой) должен быть решен соответствующими экономическими расчетами.
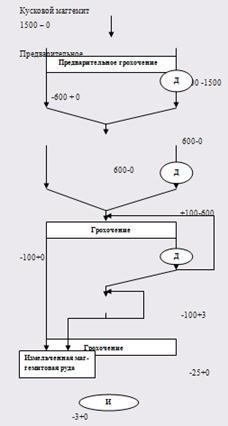
Д – дробление на молотковых дробилках;
И – измельчение на стержневой мольнице.
Рисунок 3 – Технологическая схема подготовительных процессов для обогащения
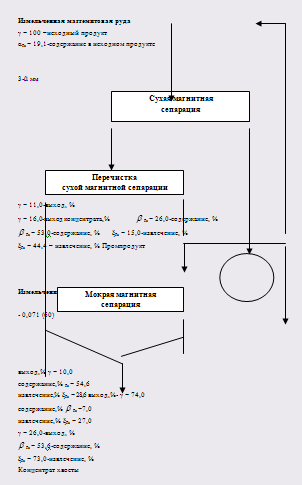
Рисунок 4 – Предлагаемая схема обогащения маггемитовой руды
5.3.1 Химизм процесса восстановления
Химический и минеральный состав промпродукта, полученного после переработки маггемитовой руды сухой магнитной сепарацией, довольно сложный, что обусловливает многообразие химических превращений при его термической обработке /5/.
Определяющей является реакция восстановления твердым восстановителем гидрогетита (3Fe2O3 · 4Н2О) через газовую фазу. Гидрогетит представляет собой твердый раствор воды в гетите (Fe2O3 ·Н2О). вода входит в кристаллическую решетку твердого раствора в гетите в виде нейтральных молекул, удаление которых становится возможным уже при температуре 120 – 200 ºС без изменения типа решетки и скачкообразных изменений ее параметров.
В решетке гетита кристаллизованная влага присутствует в виде ионов гидроокислов (ОН)-, где каждый атом водорода располагается симметрично между атомами кислорода, образуя водородную связь.
В области температур до 400 ºС происходят испарение поверхностной влаги и разложение гидрогетита до гематита (Fe2O3) путем отнятия кристаллизационной влаги:
3 Fe2O3 · 4Н2О → Fe2O3 + Н2О ↑.
При температуре 300 – 400 ºС начинается процесс дегидрации хлоритов, основными из которых является амезит – (Mq, Fe)4Al2 [Al2Si2O10](OH)8, шамозит – Fe4Al [Si3Al O10] (OH)8 и пеннин – (Mq, Fe)5Al [Al Si3O10] (OH)8.
Основу такой структуры хлоритов составляют листы из тетраэдров (SiO4), между которыми располагаются гидроксильные группы (ОН)- и катионы Fe, Al, Mq. Хлориты плотной оболочкой обрамляют зерна железных минералов. Разложенные же оболочки хлоритов отличаются сильной пористостью, наличием большого количества трещин.
Присутствие известняка (СаСО3) способствует ускоренному разложению хлоритовых оболочек на поверхности зерен оксидов железа. Процесс разложения хлоритовых оболочек известняком следует рассматривать как реакцию между твердыми фазами.
Угольный ангидрид, полученный от диссоциации известняка, вступает в соединение с углем
СО2 + С = 2СО,
образуя свободный оксид углерода, являющийся восстановителем оксидов железа.
На освобожденную от хлоритовой оболочки реакционную поверхность адсорбируются молекулы газа-восстановителя (в нашем случае СО) и вступают в реакцию с оксидом железа.
Следует отметить, что на ускорение процесса адсорбции молекул восстановителя благоприятно влияет и тот факт, что свободный оксид углерода, полученный за счет разложения хлоритовой оболочки известняком, находится в непосредственной близости от реакционной поверхности.
Восстановление оксидов железа до магнетита протекает по суммарной реакции:
3Fe2O3 + СО =2 Fe2O3 + СО2 + 8870 кал
СО2 + С = 2СО – 37710 кал
3Fe2O3 + С = 2Fe2O3 +СО – 28840 кал.
Реакция 2СО ↔ СО2 + С эндотермическая, протекает со значительным поглощением тепла.
Несколько раньше, при температуре 400 – 600 ºС, осуществляется разложение находящегося в руде сидерита по суммарной реакции:
3FeCO3 = 3FeO + 3CO2
3FeO + CO2 = Fe3O4 + CO
FeCO3 = Fe3O4 + СО + 2СО2 – 35700 кал.
Для получения кривых нагревания гидрогетита и хлоритов из руды было выделено несколоко образцов последних. Отобранное бинокулярной лупой и проверенное под микроскопом хлоритовое вещество было передано на химические и термические исследования. Химичесикй состав трех образцов приведен в таблице 12.
Таблица 12 - Химический состав хлоритов маггемитовых руд
|
Компоненты |
Образец 1 |
Образец 2 |
Образец 3 | |||
|
Масс.доля, % |
Кол-во молекул |
Масс.доля, % |
Кол-во молекул |
Масс.доля, % |
Кол-во молекул | |
|
SiO2 |
13,15 |
219 |
24,84 |
414 |
19,55 |
326 |
|
TiO2 |
0,58 |
7 |
0,33 |
4 |
0,08 |
1 |
|
Al2O3 |
13,07 |
127 |
0,00 |
- |
0,20 |
2 |
|
Cr2O3 |
3,96 |
26 |
0,47 |
3 |
0,26 |
2 |
|
Fe2O3 |
41,20 |
258 |
41,96 |
262 |
40,45 |
252 |
|
FeO |
11,23 |
158 |
12,15 |
168 |
15,62 |
217 |
|
MnO |
0,06 |
1 |
0,19 |
3 |
0,07 |
1 |
|
CfO |
0,53 |
9 |
0,00 |
- |
0,00 |
- |
|
MqO |
2,35 |
59 |
1,03 |
26 |
3,75 |
94 |
|
NiO |
0,78 |
11 |
1,19 |
16 |
0,17 |
3 |
|
CoO |
- |
- |
0,86 |
12 |
0,06 |
1 |
|
P2O5 |
0,05 |
1 |
0,12 |
1 |
0,22 |
1 |
|
H2O |
13,20 |
732 |
16,35 |
910 |
19,29 |
1077 |
|
S |
- |
- |
- |
- |
0,01 |
- |
Другие рефераты на тему «Производство и технологии»:
Поиск рефератов
Последние рефераты раздела
- Технологическая революция в современном мире и социальные последствия
- Поверочная установка. Проблемы при разработке и эксплуатации
- Пружинные стали
- Процесс создания IDEFO-модели
- Получение биметаллических заготовок центробежным способом
- Получение и исследование биоактивных композиций на основе полиэтилена высокой плотности и крахмала
- Получение титана из руды
