Термобарогеохимия в изучении кристаллических пород
Микроинфракрасная спектроскопия имеет дело с более крупными включениями (более 15-20 мкм) и, в отличие от рамановской, не позволяет определять газы, в молекуле которых имеются атомы только одного вида (N2, H2). Метод имеет ограничения вследствие поглощения минералом-хозяином инфракрасного излучения. На спектроскопах (Micro-FTIR) получают количественные и полуколичественные данные по содержанию
органических молекул, воды, CO2, COS, NH4+, CO2/H2O, кетонов, алканов и др. Возможно также исследование распределения молекулярной воды, гидроксильной и карбонатной групп в стекле расплавных включений.
В последние годы приборная аналитическая база для исследования включений интенсивно развивается. Появились методики определения легких элементов (Li, Na, Mg, F, B) и элементов с атомным номером больше 30 методами протонно-индуцированного гамма-излучения (PIGE) и протонно-индуцированного рентгеновского излучения (PIXE). Для экстракции содержимого водно-солевых включений используется различные лазеры, при этом происходит вскрытие и испарение раствора из включения и полученная плазма используется как источник протонов для эмиссионной спектроскопии. Методом лазерной индукционно-связанной плазмы уже сегодня можно анализировать включения на содержание щелочных и щелочноземельных элементов, правда, с невысокой точностью.
Микротермометрия. Наблюдения за фазовыми переходами при изменении температуры является основным методом при изучении флюидных включений. Используя специальную аппаратуру: микроскоп, оборудованный термокамерой или криокамерой, помещаемую на столик микроскопа, проводятся наблюдения за фазовыми изменениями во включении, происходящие при изменении температуры. Обычно образец исследуют при охлаждении (криометрия) и нагреве (термометрия). Все измерения производят только при повышающейся температуре, так как. при охлаждении сильно развиты явления метастабильности и, например, появление пузырька газа или замерзание включения происходит при переохлаждении иногда на несколько десятков градусов.
Криометрия. При отрицательных температурах обычно замеряются следующие температуры.
а) Температура эвтектики водно-солевых включений - появление первых порций жидкости после полного замораживания. Часто замерить ее не удается вследствие малого размера включения. По температуре эвтектики можно судить о валовом составе включения (опредление криогидратной точки), например, если замеренная температура равна -21,3оС, во включении присутствуют растворы NaCl, если она соответствует -51,5оС, - растворы NaCl+CaCl2. Значения температур эвтектики для многих растворов, присутствующих во включениях, известны и имеются во всех химических справочниках;
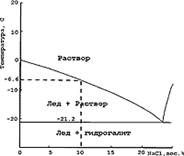
б) Температуры плавления льда и кристаллов солей, выпавших при охлаждении водно-солевых включений. Если мы имеем дело с недосыщенными растворами одной соли, после плавления эвтектики остаются только кристаллики льда. В зависимости от концентрации соли они снижают температуру плавления льда. На этом основан метод определения концентрации соли во включении. Однако, поскольку часто неизвестно, какие именно соли содержатся в изучаемых включениях, для выражения концентрации принято пользоваться понятием NaCl-эквивалент (NaCl-экв) - концентрацию соли определяют, принимая, что во включении присутствует только NaCl. Ясно, что при измеренных температурах плавления льда ниже, чем -21,3оС выразить концентрацию в NaCl-экв невозможно. На рис. 2 показана фазовая диаграмма системы H2O-NaCl при низких температурах и способ определения концентрации соли во включении на примере полученного замера -6,6оС - в растворе содержится 10 масс.% NaCl. При содержании NaCl в растворе больше 23,2%, после плавления эвтектики остается фаза гидрогалита, которую диагностирут по более высокому рельефу и очень медленной динамике растворения. Тогда для определения концентрации пользуются другой ветвью плавления на диаграмме состояния.
Часто раствор во включении представлен тройной водно-солевой системой. Тогда после плавления эвтектики измеряются температуры исчезновения нескольких фаз, последовательность растворения которых зависит от общего состава включения. Если известна соответствующая фазовая диаграмма системы, интерпретация полученных замеров возможна. Однако следует отметить, что такие данные очень ограничены. Для примера рассмотрим систему H2O-NaCl-CaCl2, приведенную на рис. 3. При -51,5оС - температуре эвтектики (точка Э) - появятся первые порции жидкости. При повышении температуры состав жидкости будет изменяться по котектической линии, пока не произойдет полное плавление гидрогалита и останется одна твердая фаза - лед (например, до точки А, при -25оС). Состав жидкости далее будет изменяться вдоль линии, соединяющей точку А с точкой воды. Пересечение этой линии с изотермой плавления льда (примем, что лед расплавился при -5оС) является фигуративной точкой валового состава включения (точка Б). В нашем примере в растворе содержится: 5 масс% NaCl и 4 мас.% CaCl2. Аналогичным способом определяется валовый состав раствора, если фигуративная точка его лежит в других полях фазовой диаграммы.
в) Во включениях, содержащих летучие в сжиженном виде (прежде всего речь идет об углекислоте, а также о H2S, CH4 и т.п.), измеряют температуру плавления твердой фазы. По ней судят о природе жидкости и о наличии примесей других летучих. Например, температура тройной точки (плавления) сероводорода -82,9оС, чистая углекислота плавится при -56,6оС, примесь азота или метана снижают температуру плавления. Если известно, какой газ присутствует в виде примеси и степень влияния его на свойства смеси, по изменению температуры плавления можно приблизительно оценить его количество.
г) Так как критические температуры почти всех летучих компонентов, кроме воды флюидных включений лежат в области отрицательных температур, температуры перехода жидкость-пар измеряют при криометрии. Если включение не содержит других компонентов, эта температура является температурой гомогенизации; в присутствии еще
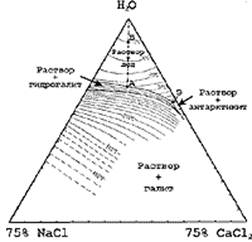
Рис. 3. Фазовая диаграмма тройной системы H2O-NaCl-CaCl2 (A.E.Williams-Jones & I.M.Samson, 1990). и водной фазы - температурой частичной гомогенизации.
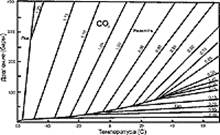
Рис.4. Фазовая диаграмма углекислоты при низких температурах
д) Если во включении наряду с газом присутствует вода, при низких температурах начинается образование так называемых газгидратов (клатратов) - твердых веществ переменного состава типа СО2,хН2О. Понятно, что измерять плотность в присутствии клатратов не имеет смысла, так как часть вещества включения израсходована на формирование высокоплотной твердой фазы. Однако, наблюдения за клатратами могут дать полезную информацию. Клатраты в чистой системе Н2О-СО2 не существуют при температуре выше +11оС. Если в воде растворена соль, температура плавления клатрата снижается пропорционально ее концентрации. Таким образом, измеряя температуру плавления клатрата (в присутствии газовой и жидкой фаз СО2), оценивают содержание соли в воде. (Рис 4)
Другие рефераты на тему «Геология, гидрология и геодезия»:
- Проектирование рецептур буровых растворов по интервалам бурения для Приобского месторождения
- Нефть и продукты её переработки
- Распределение температуры по стволу скважины с целью решения геологических и геолого-промысловых задач
- Межевание объектов землеустройства
- Тектоническое строение Астраханского газоконденсатного месторождения
Поиск рефератов
Последние рефераты раздела
- Анализ условий формирования и расчет основных статистических характеристик стока реки Кегеты
- Геодезический чертеж. Теодолит
- Геодезические методы анализа высотных и плановых деформаций инженерных сооружений
- Асбест
- Балтийско-Польский артезианский бассейн
- Безамбарное бурение
- Бурение нефтяных и газовых скважин
