Загрязнение атмосферы
Общее содержание метана в атмосфере и его концентрация. В настоящее время концентрация атмосферного метана составляет 1,8 ppm. Общее количество метана в атмосфере оценивают в пределах 4600—5000 Тг (Тг = 1012 г). В южном полушарии концентрация метана несколько ниже, чем в северном полушарии. Такое различие обычно связывают с меньшей мощностью источников метана в южном полушарии: считается, чт
о основные источники метана расположены на континентах, а океаны не вносят заметного вклада в глобальный поток метана. Время жизни метана в атмосфере 8-12 лет.
Метан находится в атмосфере в основном в приземном слое, который называется тропосферой и толщина которого составляет 11-15 км. Концентрация метана мало зависит от высоты в интервале от поверхности Земли до тропопаузы, что обусловлено большой скоростью перемешивания по высоте в пределах 0-12 км (1 месяц) в сравнении со временем жизни метана в атмосфере.
Изменение концентрации метана во времени.
Изменение концентрации метана в атмосфере Земли примечательно тем, что позволяет наглядно представить себе характер и масштаб влияния человеческой деятельности на глобальные процессы. Концентрация метана в 70-е годы увеличивалась в атмосфере со скоростью 0,8—1,2% в год, что эквивалентно увеличению концентрации на 16,5 ppbv (ppbv — одна часть на миллиард) в год, а прирост его массы в атмосфере составлял 45 Тг/год. Возникает вопрос, всегда ли было так, что концентрация атмосферного метана ежегодно возрастала. Оказывается, можно проследить изменения в концентрации метана на протяжении 150 тысяч лет и более. С этой целью отбирают керны в материковых льдах Антарктиды или Гренландии. В частности, большое число данных получено на российской станции "Восток" в Антарктиде. Лед в кернах имеет разный возраст: чем глубже он расположен, тем он старше. Состав воздуха в пустотах льда на различной глубине соответствует составу атмосферы в момент образования льда.
Изменение концентрации метана в атмосфере Земли за последние 140 тыс. лет представлены на рис. 1. Кривая осадков характеризует оледенения: мало осадков - оледенение, много осадков - потепление. Из рис. 1 видно, что во время оледенений концентрация метана падала и иногда достигала рекордно низких значений (например, 0,35 ppm). Важно отметить, что концентрация метана до новой эры никогда не превышала 0,7 ppm. Естественно, что до новой эры интенсивность хозяйственной деятельности человечества была незначительной и поэтому наблюдаемая концентрация метана обеспечивалась только естественными факторами.
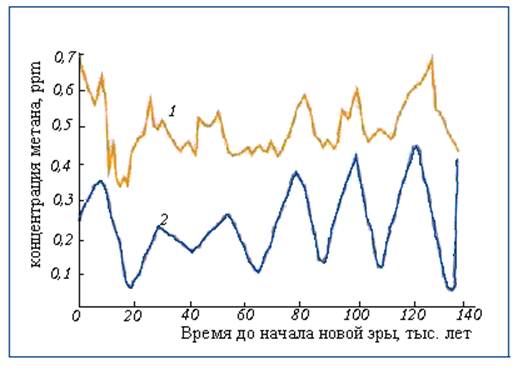
Рис. 1. Зависимость концентрации метана в атмосфере Земли (1) и зависимость осадков от времени, отн. ед. (2)2
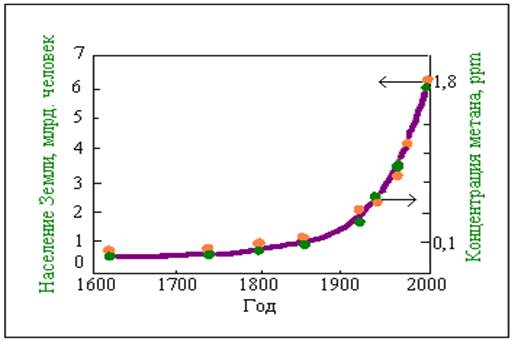
Рис. 2. Изменения содержания метана в атмосфере и населения Земли во времени3
Анализы показывают, что от Рождества Христова вплоть до XVII века концентрация метана в атмосфере Земли была практически постоянной и составляла примерно 0,7 ppm Затем концентрация метана стала повышаться и одновременно начался интенсивный рост населения Земли (рис. 2) На рис. 2 видно, что за последние 300 лет концентрация метана возросла на 1,1 ppm. Можно полагать, что этот прирост обусловлен деятельностью человечества. Из данных рис. 2 следует, что в период с начала 60-х годов по настоящее время произошло удвоение прироста концентрации метана, составившее примерно 0,55 ppm и за это же время удвоилось население земного шара.
Интересное событие произошло в 80-90-е годы: прирост концентрации метана начал падать. Причины этого не вполне ясны Высказывалось робкое предположение, что это связано с тем, что Россия смогла починить свои газопроводы и это привело к остановке в росте концентрации метана. Однако простые оценки показывают [4], что Россия не имеет к этому никакого отношения и что, скорее всего, включились некоторые факторы пока неизвестной природы. Более детальное рассмотрение указанных явлений требует знаний о механизмах поступления метана в атмосферу и о процессах вывода метана из атмосферы.
Стоки метана.
Рассмотрение поведения метана в атмосфере начнем с процессов исчезновения метана. Дело в том, что процессы вывода метана из атмосферы известны в количественном отношении гораздо полнее, чем процессы, обеспечивающие поступление метана в атмосферу. Интенсивность процессов стока метана должна быть примерно равной интенсивности источников метана, что
позволяет более надежно судить о мощности источников метана в атмосфере.
Молекула метана довольно устойчива, и ее нелегко вывести из атмосферы. Метан малорастворим в воде (30 см3 газа растворяется в одном литре воды), и удаление его из атмосферы с помощью осадков не происходит. Для реального удаления из атмосферы метан необходимо переводить в нелетучие соединения или другие газообразные соединения.
Метан, как и многие другие примеси, исчезает из атмосферы, в основном в реакции с радикалом ОН:
ОН + СН4 = Н2О + СНз
Если концентрация метана в атмосфере не растет, то это означает, что скорость поступления метана в атмосферу равна скорости его вывода. Поэтому количественные характеристики этой реакции между метаном и радикалом ОН чрезвычайно важны, так как ошибка в 25% приведет к ошибке примерно в 25% в расчете мощности источников метана. Параметры этой реакции определялись многократно, и тем не менее последние данные показывают, что 10-15 лет назад скорость реакции определялась завышенной примерно на 25%. Это означает, что поток метана в атмосферу с поверхности Земли составляет примерно 400, а не 500 Тг/год, как считалось ранее. Возникает естественный вопрос об источнике радикалов ОН. Необходимо отметить, что радикал ОН — одна из наиболее реакционноспособных частиц в химических процессах. Источником радикала ОН в тропосфере является тропосферный озон (Од). Под действием ультрафиолетового света с длиной волны короче 310 нм молекулы тропосферного озона разрушаются с образованием молекулы кислорода и чрезвычайно реакционноспособного атома кислорода в возбужденном электронном состоянии (0(1D)):
03+hv (310 нм и короче) = О2 + 0(1D)
Атомы кислорода отрывают один атом водорода от воды и получается два радикала ОН:
0(1D) + Н2О = 20Н
Итак, реакции в атмосфере, приводящие к выводу метана, таковы:
ОН + СН4 = Н20 + СНз,
СНз + О2 = СНзО2,
СНзО2 + NO = СНзО + NO2,
СНзО + 02 = СН2О + НО2,
HO2 + NO = OH + NO2,
2[NO2 + hv = NO + 0],
2[0+02 = 0з],
СН4 + 402 = СН2О + Н20 + 20з
Таким образом, в результате многоступенчатого процесса образуются по одной молекуле формальдегида и воды и две молекулы озона. NO и NO2 (NOх) всегда присутствуют в атмосфере в количествах, достаточных для протекания реакции с их участием.
Из приведенных реакций видно образование нестабильных валентно-ненасыщенных частиц, таких, как СНзО2 или НО2. Эти частицы играют важную роль в процессах в атмосфере. Формально их образование можно представить в процессах отрыва атома водорода от стабильных молекул метилгидроперекиси и перекиси водорода соответственно. Присутствие свободной валентности приводит к высокой реакционной способности, так как эти частицы стремятся к образованию стабильных связей и насыщению валентностей.
Другие рефераты на тему «Экология и охрана природы»:
Поиск рефератов
Последние рефераты раздела
- Влияние Чекмагушевского молочного завода на загрязнение вод реки Чебекей
- Влияние антропогенного фактора на загрязнение реки Ляля
- Киотский протокол - как механизм регулирования глобальных экологических проблем на международном уровне
- Лицензирование природопользования, деятельности в области охраны окружающей среды и обеспечения экологической безопасности
- Мировые тенденции развития ядерной технологии
- Негативные изменения состояния водного бассейна крупного города под влиянием деятельности человека
- Общественная экологическая экспертиза и экологический контроль
