Биологическое загрязнение биосферы
Естественные источники Естественные источники
соединений серы. NOx
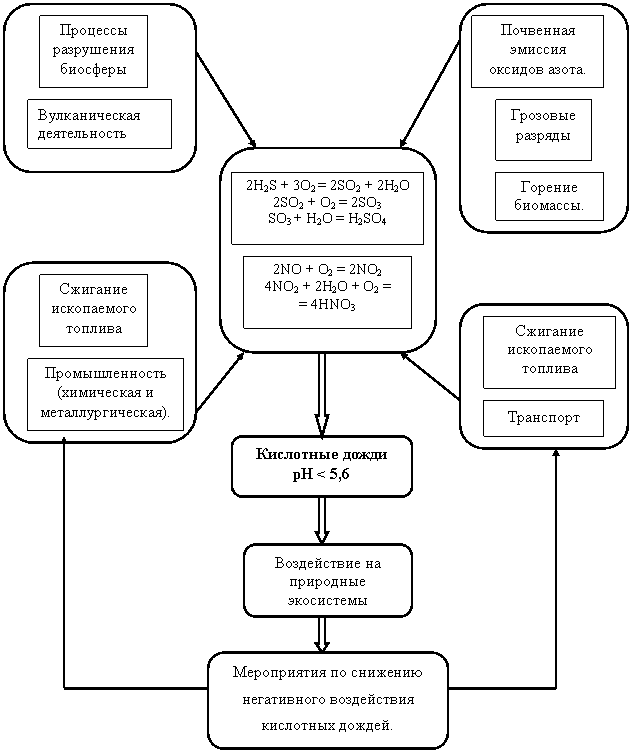
Атмосфера
Антропогенные источники
соединений серы.
Антропогенные источники
NOx
Рис.1 Блок-схема модели возникновения кислотных дождей в атмосфере.
Загрязнение атмосферного воздуха таит в себе угрозу не только здоровью людей, но и наносит большой экономический ущерб. Наличие в воздухе соединений серы ускоряет процессы коррозии металлов, разрушение зданий, сооружений, памятников культуры, ухудшает качество промышленных изделий и материалов. Установлено, например, что в промышленных районах сталь ржавеет в 20 раз, а алюминий разрушается в 100 раз быстрее, чем в сельской местности.
Вредные для человека и для природы выбросы могут перемещаться в воздушных потоках на громадные расстояния. Например, установлено, что выбросы промышленных предприятий ФРГ и Великобритании переносятся на расстояния более 1000 км и выпадают на территории скандинавских стран, а из северо-восточных штатов США - на территории Канады. Вредоносные последствия загрязнения среды сказываются и в нашей стране. Так, по данным Европейской экономической комиссии ООН, через российскую границу в воздушных потоках с запада на восток идет в 4 раза больше серы, чем в обратном направлении.
Несколько десятилетий назад выражения “кислотные осадки” и “кислотные дожди” были известны лишь исключительно ученым, посвященным в определенных, специализированных областях экологии и химии атмосферы. За последние несколько лет эти выражения стали повседневными, вызывающими беспокойство во многих странах мира. Проблема кислотных дождей стала одной из экологических проблем глобального масштаба. Кислотные осадки являются проблемой, которая в случае ее бесконтрольного развития, может вызвать и уже в некоторых регионах вызывает существенные экономические и социальные издержки. Имитационная модель возникновения кислотных дождей в атмосфере может быть использована для решения этой проблемы. Из этой модели видно, что основной причиной кислотных дождей является антропогенная деятельность. Международный исследовательский институт прикладного системного анализа (IIASA) проводит изучение моделей с целью установления возможной кислотности почв, вод и т.п. через десятки лет. Результаты говорят о том, что почвы и леса в Европе могут быть спасены от дальнейшего закисления только путем значительного сокращения выбросов. Эти выбросы должно самостоятельно регулировать каждое государство. Для уменьшения эмиссии загрязняющих веществ в атмосферу существует ряд способов:
- сильное сокращение использования энергии;
- ввод новых технологий, установка фильтрующего оборудования;
- использование слабозагрязняющих либо совсем незагрязняющих источников энергии.
Подобное решение звучит довольно нереально. Ни одно государство не согласится уменьшить масштабы потребления энергии и тем самым ухудшить уровень жизни. Ввод новых технологий и установка фильтрующего оборудования также представляют собой экономическую проблему. Тем не менее, единственным решением проблемы кислотных дождей видится в сокращении потребления энергии, улучшении контроля над выбросами или разработке альтернативных методов производства электроэнергии, иначе мы, несмотря, ни на какие усилия, окажемся на «непригодной для жизни планете».
КИСЛОТНЫЕ ДОЖДИ
Термином "кислотные дожди" называют все виды метеорологических осадков - дождь, снег, град, туман, дождь со снегом, - рН которых меньше, чем среднее значение рН дождевой воды (средний рН для дождевой воды равняется 5.6). Выделяющиеся в процессе человеческой деятельности двуокись серы (SO2) и окислы азота (NОx) трансформируются в атмосфере земли в кислотообразующие частицы. Эти частицы вступают в реакцию с водой атмосферы, превращая ее в растворы кислот, которые и понижают рН дождевой воды. Впервые термин "кислотный дождь" был введен в 1872 году английским исследователем Ангусом Смитом. Его внимание привлек викторианский смог в Манчестере. И хотя ученые того времени отвергли теорию о существовании кислотных дождей, сегодня уже никто не сомневается, что кислотные дожди являются одной из причин гибели жизни в водоемах, лесов, урожаев, и растительности. Кроме того, кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как двуокись углерода (СО2), вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота (CO2 + H2O -> H2CO3). [5, с. 423-424] Тогда как в идеале рН дождевой воды равняется 5.6-5.7, в реальной жизни показатель кислотности (рН) дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это, прежде всего, зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
В 1883 году шведский ученый Сванте Аррениус ввел в обращение два термина - кислота и основание. Он назвал кислотами вещества, которые при растворении в воде образуют свободные положительно заряженные ионы водорода (Н+). Основаниями он назвал вещества, которые при растворении в воде образуют свободные отрицательно заряженные гидроксид-ионы (ОН-). Термин рН используют в качестве показателя кислотности воды. "Термин рН значит в переводе с английского "показатель степени концентрации ионов водорода". [5, с. 428]
Значение рН измеряется на шкале от 0 до 14. В воде и водных растворах присутствуют как ионы водорода(Н+), так и гидроксид-ионы (ОН-). Когда концентрация ионов водорода (Н+) в воде или растворе равна концентрации гидроксид-ионов (ОН-) в том же растворе, то такой раствор является нейтральным. Значение рН нейтрального раствора равняются 7 (на шкале от 0 до 14). Как вы уже знаете, при растворении кислот в воде повышается концентрация свободных ионов водорода (Н+). Они то и повышают кислотность воды или, иными словами, рН воды. При этом, с повышением концентрации ионов водорода (Н+) понижается концентрация гидроксид-ионов (ОН-). Те растворы, значение рН которых на приведенной шкале находится в пределах от 0 до <7, называются кислыми. Когда в воду попадают щелочи, то в воде повышается концентрация гидроксид-ионов (ОН-). При этом в растворе понижается концентрация ионов водорода (Н+). Растворы, значение рН которых находится в пределах от >7 до 14, называются щелочными.
Следует обратить внимание еще на одну особенность шкалы рН. Каждая последующая ступенька на шкале рН говорит о десятикратном уменьшении концентрации ионов водорода (Н+) (и, соответственно, кислотности) в растворе и увеличении концентрации гидроксид-ионов (ОН-). Например, кислотность вещества со значением рН4 в десять раз выше кислотности вещества со значением рН5, в сто раз выше, чем кислотность вещества со значением рН6 и в сто тысяч раз выше, чем кислотность вещества со значением рН9.
Другие рефераты на тему «Экология и охрана природы»:
Поиск рефератов
Последние рефераты раздела
- Влияние Чекмагушевского молочного завода на загрязнение вод реки Чебекей
- Влияние антропогенного фактора на загрязнение реки Ляля
- Киотский протокол - как механизм регулирования глобальных экологических проблем на международном уровне
- Лицензирование природопользования, деятельности в области охраны окружающей среды и обеспечения экологической безопасности
- Мировые тенденции развития ядерной технологии
- Негативные изменения состояния водного бассейна крупного города под влиянием деятельности человека
- Общественная экологическая экспертиза и экологический контроль
