Углеводы
Введение
По химической классификации, все углеводы являются полигидроксикарбонильными соединениями. Номенклатура их, как и в большинстве случаев природной химии, носит тривиальный характер, систематический подход разработан и им удобно пользоваться при названии производных углеводов и обозначении характерных структурных элементов. Общее окончание для всех углеводов, исключая полиме
рные системы - оза.
Здесь следует отметить, что обычно углеводы подразделяют в первую очередь на моносахариды, олигосахариды и полисахариды. Но так как моносахара являются фундаментальными углеводными единицами, а олигосахара и полисахара - это не что иное, как их производные, то мы и будем придерживаться этой схемы: не выделять олигосахара в отдельный класс, рассматривая их как соответствующие производные моносахаров.
1. Классификация
Классификация углеводов ступенчатая. В первую очередь, отмечается количество атомов углерода углеводородной части молекулы - тетрозы, пентозы, гексозы, гептозы и т.д. Наиболее распространенными являются пентозы и гексозы. В зависимости от числа атомов углерода в моносахаридной цепочке, их подразделяют на низшие, обычные и высшие моносахара с количеством углеродных атомов от 7 до 10. Нормальные углеводы структурно расходуют один углеродный атом на карбонильную группу, при всех остальных углеродных атомах находится по одной гидроксильной группе. Вторая ступень классификации связана с расположением карбонильной группы в углеводородной цепи - либо это альдегидная группа, либо кетонная - ив соответствии с этим, мы имеем либо альдозы, либо кетозы. С учетом первой ступени классификации, мы можем теперь различать альдопентозы, альдокетозы, альдогексозы, кетогексозы и т.д.
Следующий этап подразделения углеводов определяется пространственным структурным фактором, а именно, наличием асимметрических центров. Как видно на схеме 1, молекула альдозы содержит асимметрических центра, молекула кетозы - таких центра: это значит, что альдогексозы могут существовать в виде 24 конфигурационных изомеров, кетогексозы - в виде 23 конфигурационных изомеров. Учитывая структурное соотношение между диастереомерными и энантио-мерными формами, в простейшем варианте рассмотренное нами на примере винных кислот, можно уточнить: альдогектозы будут представлены 8 диастереомерами, каждый из которых может существовать в виде пары оптических антиподов.

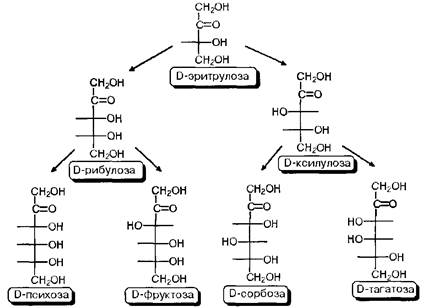
Диастереомеры различаются между собой различным взаимным расположением гидроксильных групп в пространстве, в результате чего они будут существенно различаться физическими и, в некоторой степени, химическими свойствами. В связи с этим, а также с учетом важности этих индивидуальных соединений в природной химии, каждому из диастереомеров присвоено свое собственное тривиальное название. Оптические же антиподы обозначают индексами D - и L - в зависимости от конфигурации последнего, по нумерации углеводородной цепи, асимметрического центра Так как при переходе от углеводной молекулы с п-асимметрическими центрами к молекуле с центрами количество конфигурационных изомеров удваивается, то, приняв за минимальную альдозу глицериновый альдегид и минимальную кетозу - эритрулозу, мы можем построить иерархическую схему стереохимического родства природных углеводов с учетом того факта, что, в основном, они относятся к D-ряду в проекциях Фишера.
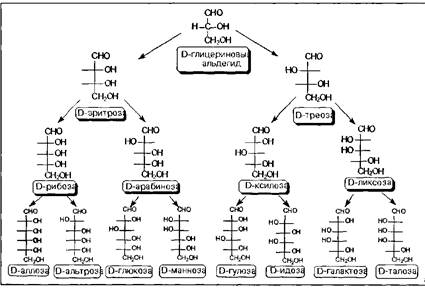
Доказательство строения и стереохимического родства восьми D - гексоз и четырех D-пентоз было основано на блестящих работах Эмиля Фишера, за которые он получил Нобелевскую премию по химии в 1901 году.
Относительно особенностей конфигураций D - и L-рядов моносахаров следует отметить два факта:
1. Обозначение D - и L - не находятся во взаимосвязи со знаком их оптического вращения.
2. Живые организмы "не узнают" и "не умеют" усваивать углеводы L-ряда, тогда как синтезировать они их могут. Свойство инертности ферментов к L - сахарам природа часто использует для построения сложных устойчивых молекулярных систем.
2. Свойства и структура моносахаридов
Специфика химических свойств углеводов заключается уже в том, что не имеет смысла рассматривать отдельно реакции, обусловленные только спиртовыми функциями или только карбонильными. Прежде всего, мы познакомимся с теми их свойствами, которые обусловлены взаимным влиянием этих функций, поскольку результатом их взаимного влияния являются существенные структурные изменения и появление новых химических свойств молекул моносахаридов.
Поскольку карбонильные группы обладают ярко выраженной способностью к присоединению нуклеофильных реагентов, а в молекулах Сахаров присутствуют эти нуклеофильные группы в количестве, более чем достаточном, то естественно ожидать от них осуществления этой реакции внутримолекулярным вариантом. И она осуществляется. Остается только выяснить, какой именно гидроксил осуществляет этот процесс и каков результат этого процесса.
Согласно пространственному строению моносахаридной молекулы, наиболее благоприятны для нуклеофильной атаки гидроксильные группы при углеродах С4, Cs и С6, если мы за основу возьмем альдогексозу; С4 и Cs - если за основу возьмем альдопентозу. Второй фактор, влияющий на выбор гидроксильной группы для этой реакции - это устойчивость образующегося циклического полуацеталя: образование малых циклов энергетически невыгодно из-за байеров-ского напряжения; образование больших циклов невыгодно по причине торсионных дестабилизирующих взаимодействий.
Из классической органической химии известно, что пяти - и шестичленные циклы, как карбоциклические, так и гетероциклические, термодинамически наиболее предпочтительны.
Следствием этих основных факторов является преимущественное образование шестичленного циклического полуацеталя в случае глюкозы, пятичленного циклического полуацеталя в случае рибозы, пятичленного циклического полуацеталя в случае фруктозы. В номенклатуре соединений это отражают введением названия соответствующего кислородного гетероцикла в качестве корневого слова - пираноза и фураноза. Но надо еще раз подчеркнуть, что такое формирование циклических форм является преимущественным: образование фураноз в случае альдогексоз и пираноз в случае альдопентоз также не исключено.
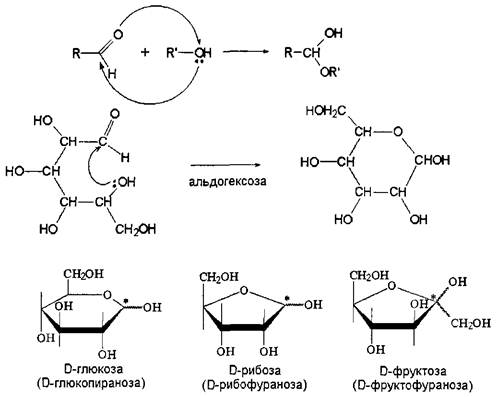
Согласно предложению Хеуорса, формулы всех циклов представляют схематически плоскими, что удобно для представления взаимного расположения гидроксильных групп, а для пятичленных циклов это близко к истине
При анализе циклических структур моносахаридов первое, что мы можем отметить - это исчезновение карбонильной функции и появление новой гидроксильной функции при С1 и, соответственно, нового асимметрического центра при этом же углеродном атоме Так вот, в силу планарности карбонильной группы, присоединение реагента к ней возможно с обеих сторон плоскости, результатом чего является пара циклических изомеров, называемых а - и в-формами А во-вторых, возникает вопрос, что же является истиной для моносахаридов в структурном плане9 Многочисленными пионерскими работами в начале двадцатого столетия, основанными на виртуозных химических превращениях, а также современными исследованиями, в большей степени использующими физические методы показано, что в растворах существует динамическое равновесие между всеми тремя формами, а в кристалле - только циклические формы в зависимости от природы углевода и условий кристаллизации Динамическое равновесное состояние моносахаридов называют кольчато-цепной таутомерией. Соотношение между различными формами таутомерной смеси в растворе весьма трудно определяемо, так как оно в существенной степени зависит от природы моносахарида и от среды.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
