Антибиотические белки и пептиды и воспалительный процесс
Катионные пептиды и белки, будучи представленными в значительных количествах в мобильных клетках принимают активное участие в гуморально-клеточной кооперации крови и соединительной ткани в ходе такого сложного патофизиологического процесса, каким является острое воспаление. Воспаление есть возникший в эволюции процесс реагирования организма человека и животных на местные повреждения, который
включает в себя в качестве взаимосвязанных компонентов сложные поэтапные изменения микроциркуляторного русла, системы крови и соединительной ткани, направленные в конечном итоге на изоляцию и устранение патогенного агента и восстановление поврежденных тканей. Своеобразие этого процесса заключается в том, что далеко не все компоненты тканевых изменений в очаге воспаления представляют собой выражение только защитных реакций организма. Например, избыточная миграция нейтрофильных гранулоцитов в воспаленные ткани может быть причиной формирования абсцесса и резкого нарушения функциональной активности конкретной биологической системы. Однако в нашей оценке биологической роли воспаления мы должны исходить из представлений о первично защитном характере таких его реакций, как свертывание крови в поврежденных патогенным фактором сосудах, препятствующее кровопотере, увеличение проницаемости сосудов микроциркуляторного русла и поддержание в них крови в жидком состоянии, накопление в очаге нейтрофильных гранулоцитов с последующей их заменой клетками системы мононуклеарных фагоцитов. На всех стадиях воспаления активными и непосредственными участниками происходящих физико-химических процессов являются катионные пептиды и белки НГ.
Формирование очага воспаления характеризуется стереотипным развертыванием переходящих одна в другую реакций сосудистого ложа места повреждения. Нарушение структурно-функциональной целостности клеток и тканей при воздействии патогенного фактора приводит к кратковременному сужению артериол, венул и капилляров микроциркуляторного русла, сменяющимся последующей длительной фазой вазодилатации. Расширение сосудов, инициируемое гистамином из тучных клеток рыхлой соединительной ткани, способствует их интенсивному кровенаполнению. Параллельно с этим процессом наблюдается существенное повышение проницаемости стенок сосудов, которое благоприятствует выходу плазмы крови в экстравазальное пространство и формированию отека. Рассматриваемые сосудистые изменения, наряду с миграцией НГ, являются решающими в завязывании и развитии воспаления. Поэтому не случаен интерес многих исследователей к вопросу о природе веществ, обеспечивающих повышение проницаемости сосудов в этих условиях. Среди таких соединений фигурируют в настоящее время кинины, ангиотензин II и некоторые представители группы катионных белков нейтрофильных гранулоцитов.
Первые экспериментально обоснованные представления о провоспалительной активности катионных пептидов и белков НГ сформировались уже в 60-х годах нашего столетия. Они базировались на работах, в которых была продемонстрирована способность низкомолекулярных неферментных катионных белков НГ кролика и крысы вызывать значительное увеличение проницаемости сосудов у животных, которым внутрикожно инъецировали эти вещества. Данный эффект наблюдали немедленно после введения дефенсинов. Причем было установлено, что большая часть катионных пептидов и белков увеличивает проницаемость сосудов путем непосредственного взаимодействия с их стенками, в то время как другая — через предварительное освобождение гистамина из тучных клеток. Полианионы отменяли наблюдаемое явление, как и предварительная обработка белков трипсином. Эти данные обосновали представление о лизосомных катионных пептидах и белках НГ как медиаторах воспаления, выступающих в ходе развертывающегося патофизиологического процесса в роли факторов проницаемости и дегрануляторов тучных клеток. В основе рассматриваемой физиологической активности этой группы веществ лежит их повышенная тропность к отрицательно заряженным компонентам стенок кровеносных сосудов. В частности, после адсорбции на поверхности клеток антибиотические пептиды и антибиотические белки уже за счет гидрофобных взаимодействий с липофильными хвостами жирных кислот мембран нарушают упорядоченную структуру липидного бислоя плазмалеммы, изменяя ее барьерную и метаболическую функции.
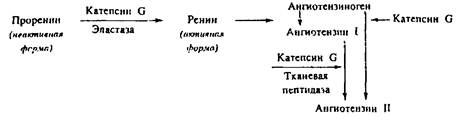
Наряду с неферментативным механизмом увеличения проницаемости сосудов существуют и другие пути участия катионных белков НГ в регуляции воспаления. Они связаны в основном с протеолитической активностью сериновых протеин аз, которые способны активировать калликреин-кининовую, ренин-ангиотензиновую и комплементарную системы и генерировать таким образом вазоактивные соединения. К числу последних относится и ангиотензин II, который обычно образуется из неактивного предшественника — ангиотензиногена в результате его последовательного двухступенчатого протеолиза под действием ренина и тканевой пептидазы. В серии работ было показано, что в условиях очага воспаления катепсин G нейтрофильных гранулоцитов человека может выполнять функции, аналогичные двум названным протеин азам. Катепсин G может внеклеточно осуществлять ограниченный протеолиз молекулы ангиотензиногена с образованием ангиотензина II — пептида, увеличивающего проницаемость сосудов и повышающего артериальное давление. В дополнение к этому катепсин G и эластаза нейтрофильных гранулоцитов способны осуществлять конверсию проренина в ренин, способствуя таким образом запуску основного пути формирования ангиотензина II. Схематически весь каскадный процесс с участием в нем лейкоцитарных протеаз выглядит следующим образом:
В нейтрофильных гранулоцитах выявлены и кининобразующие сериновые протеиназы. Кинины являются вазоактивными пептидами, обеспечивающими длительное увеличение проницаемости сосудов, расширение артериол и повышение давления в капиллярах и венулах. Обычно они являются конечным продуктом каскадной калликре-ин-кининовой системы, запускаемой фактором Хагемана. На основании ингибиторного анализа есть основания предполагать, что эластаза НГ является кинин-генерирующим ферментом, однако строгих доказательств этого положения до настоящего времени не получено.
Ключевую роль в патогенезе воспаления играет система комплемента. Физиологически активные соединения, продуцируемые в ходе ее активации, оказывают существенное влияние не только на состояние проницаемости сосудов, но и характер клеточных реакций очага воспаления. Исследованиями доказано участие сериновых протеиназ НГ в формировании биологически активных производных комплемента.
В соответствии с устоявшимися представлениями система комплемента состоит из плазменных белков, образующих 9 функционально значимых компонентов. Последовательное включение этих компонентов в формирование реакций фагоцитоза и воспаления носит название процесса активации комплемента, осуществляемого путем избирательного расщепления их белковых молекул с образованием физиологически активных полипептидных фрагментов. Среди последних ведущими являются универсальный опсонизирующий фактор СЗЬ, ответственный за единообразную маркировку объектов фагоцитоза и облегчающий их поглощение нейтрофильными гранулоцитами и макрофагами, а также анафилатоксин С5а — основной хемотаксический агент, обеспечивающий направленную миграцию нейтрофильных гранулоцитов в очаг воспаления. Традиционно рассматриваются два основных пути активации комплемента: классический и альтернативный. В дополнение к ним обнаружен новый вариант активации системы комплемента, связанный с деятельностью эластазы и катепсина G нейтрофильных гранулоцитов. Продемонстрировано, что сериновые протеиназы НГ могут осуществлять прямую конверсию компонента комплемента СЗ с образованием фрагментов СЗа и СЗЬ. Эти же ферменты обладают С5-конвертирую-щей активностью, благодаря которой от CS отщепляется фрагмент С5а. Таким образом, наряду с альтернативным путем активации системы комплемента существует дополнительная возможность вовлечения ее в различные процессы гуморально-клеточной кооперации при фагоцитозе и воспалении в начальной фазе формирования резистентности организма человека и позвоночных животных. Образование СЗЬ и С5а под действием эластазы и катепсина G может обеспечивать адекватную клеточную реакцию очага воспаления, направленную на распознавание, поглощение и эффективную элиминацию патогенных факторов. Эти полипептиды ответственны за полноценное проявление таких форм функциональной деятельности НГ, как хемотаксис, адгезивность, метаболический взрыв и микробоцидность. Поэтому их генез в процессе воздействия сериновых протеиназ НГ на компоненты СЗ и С5 комплемента может рассматриваться в качестве одного из дополнительных механизмов активации фагоцитов крови, соединительной ткани и очагов воспаления.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
