Количественный анализ
Рассчитать процентный состав смеси по следующим результатам хроматографирования
|
Компонент |
o-ксилол |
m-ксилол |
n-ксилол |
Этилбензол | >
|
Площадь пика, мм2 |
16,7 |
20,3 |
8,5 |
30,4 |
|
Поправочный коэффициент |
0,84 |
0,81 |
0,81 |
0,82 |
Найти:
W(o-ксилол)-?; W(m -ксилол)-?; W(n -ксилол)-?; W(Этилбензол)-?.
Решение
Для расчета массовых долей o-ксилола, m-ксилола, n-ксилола, этилбензола используем формулу внутренней нормализации:
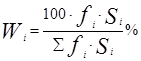
![]() 16,7∙0,84+20,3∙0,81+8,5∙0,81+30,4∙0,82=62,28%
16,7∙0,84+20,3∙0,81+8,5∙0,81+30,4∙0,82=62,28%
W(o-ксилола)=![]()
W(m -ксилола)= ![]()
W(n -ксилола)= ![]()
W(этилбензол)= ![]()
Ответ: W(o-ксилол)=22,53%; W(m -ксилола)=26,40%; W(n -ксилола)=11,06%; W(этилбензола)=40,03%
№ 50
Для определения содержания Pb в цинковой руде методом добавок навеску руды 2,2665 г. растворили и после соответствующей обработки объем раствора довели до 200 мл для снятия полярограммы взяли 20мл этого раствора. Высота волны оказалась равной 25 мм. После добавки 4,5 мл 0,008 М соли свинца высота волны увеличилась до 35 мм. Определить процентное содержание Pb в руде.
Дано: m руды=2,2665 г.
Найти: W(Pb) в руде =?%
Vобщ.р-ра=200 мл
Vр-ра водн на анализ=20 мл
hx=25 мм
V(Pb соли)=4,5 мл
С (Pb соли) =0,008 М
Hдобавк.=35 мл
Решение
1. Находим содержание свинца в 4,5 мл добавке:
n=V∙c=0.0045 л∙0,008 моль/л = 0,000036 моль
2. Находим количество свинца в 20 мл исследуемого раствора:
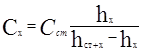
![]()
3. Находим количество вещества свинца в 200мл раствора:
0,00009 моль Pb находится в 200 мл общего раствора
![]()
4. Находим массу свинца в руде:
![]()
5. Находим массовую долю свинца в руде:
W(Pb)=![]()
Ответ: W(Pb)=8,22%.
№ 38 Опишите основы качественного полярографического анализа. Нарисуйте полярограмму, укажите на ней потенциал полуволны. Докажите, что потенциал полуволны не зависит от концентрации разряжающихся на электроде ионов.
Решение
Методы примой полярограммы основаны на непосредственном применении уравнения полярографической волны
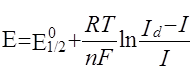 (1)
(1)
Потенциал полуволны не зависит от концентрации и является качественной характеристикой вещества. Обычно потенциал полуволны определяют графическим методом. Уравнение (1) показывает, что 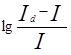 является линейной функцией Е, и, следовательно, если на график нанести
является линейной функцией Е, и, следовательно, если на график нанести 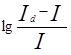 как функцию Е, то получиться прямая, которая пересекает ось абсцисс в точке, где Е=Е01/2, т.е. когда
как функцию Е, то получиться прямая, которая пересекает ось абсцисс в точке, где Е=Е01/2, т.е. когда 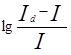 =0 (рис.1).
=0 (рис.1).
|
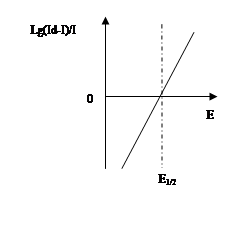
Для идентификации неизвестного вещества можно этим методом определить потенциал полуволны и, пользуясь таблицей потенциалов полуволны или полярографическим спектром, установить наиболее вероятный элемент. Однако чаще всего это свойство используется для выбора фонового электролита. Зная качественный состав пробы, подбирают по табличным данным такой фон, на котором полярографическая волна определяемого элемента может быть получена без каких-либо искажений за счет волны мешающего элемента или ионного электродного процесса.
№27
Укажите возможности амперометрического титрования. Приведите основные типы кривых амперометрического титрования.
Решение
Амперометрическое титрование применяется для определения катионов и анионов в различных технических и природных объектах, минеральном сырье и продуктах его переработки, природных водах, промышленных растворах, продуктах металлургии и т.д., а также в анализе многих органических веществ. Использование реакций различного типа (осаждения, комплексообразования и окисления-восстановления) позволяет подбирать условия амперометрического титрования для большинства элементов периодической системы. Значительно расширились возможности амперометрического титрования в связи с применением органических реагентов, аналитические достоинства которых (селективность, чувствительность) хорошо известны. Многие из них способны к электрохимическим превращениям на электродах, что еще больше повышает их ценность, так как позволяет проводить амперометрическое титрование по току титранта. Для амперометрического титрования характерна экспрессность, его можно проводить в разбавленных растворах (до 10-5 моль/л и меньше) и анализировать мутные и окрашенные растворы.
С помощью амперометрического титрования можно:
1) определить концентрацию изучаемого соединения в растворе;
2) устанавливать стехиометрические соотношения, при которых образуются соединения в результате химического взаимодействия между определяемым веществом и титрантом;
3) определить величину произведения растворимости осадка, образующегося в процессе титрования.
В зависимости от того, какое из веществ окисляется или восстанавливается на электроде при выбранном значении потенциала, кривые титрования могут быть различного типа (см. рис 1).
1. Электрохимически активно только определяемое вещество, т.е. только оно восстанавливается или окисляется на электроде. Пример: титрования солей Fe2+ окислителями при потенциале вращающегося платинового электрода +0,8В (рис.1а). В этом случае на электроде протекает реакция окисления:
