Производство азотной кислоты
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и обо
ронной технике.
1. Товарные и технологические свойства азотной кислоты
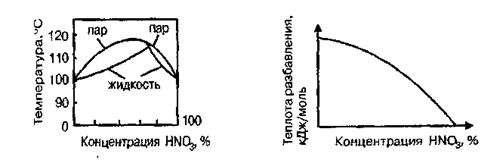
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3·Н2О и HNO3 · 3Н2О, которые дают три эвтектики (рис. 1.1).
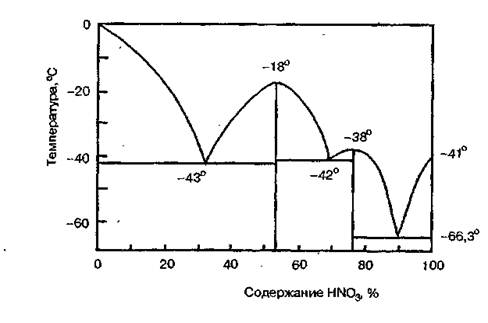
Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2»
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.
![]()
Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:
![]()
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).
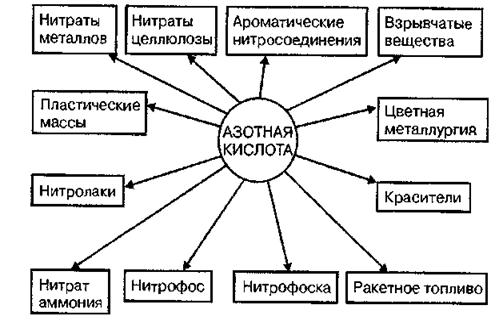
Рис. 1.4. Области применения азотной кислоты.
2. Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака, как это видно из рис. 2.1.
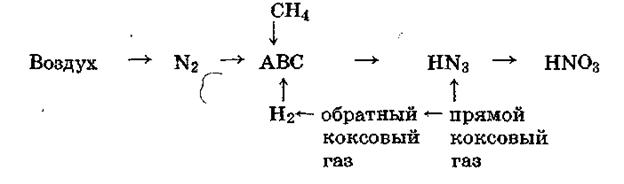
Рис. 2.1. Сырье для производства азотной кислоты.
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
3. Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
—получение разбавленной кислоты с последующим концентрированием ее в случае необходимости и
—непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой:
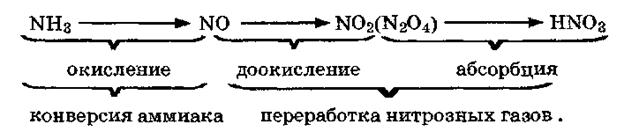
Первая стадия процесса (конверсия аммиака) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более совершенные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и, в конечном итоге, позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимость частой замены его, что связано с остановкой производства.
Технико-экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600—800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
4. Физико-химические основы синтеза азотной кислоты из аммиака
4.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
4NH3 + 502 = 4NO + 6Н20 - ΔН ΔН=907,3 кДж (1)
4NH3 + 402 = 2N20 + 6Н20 - ΔН ΔН = 1104,9 кДж (2)
4NH3 + 302 = 2N2 + 6Н20 - ΔН ΔН = 1269,1 кДж (3)
а также реакция с участием образующегося оксида азота (II):
4NH3 + 6NO = 5N2 + 6H20-ΔН ΔН = 110кДж (4)
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1—4. Из трех основных реакций окисления аммиака (1 — 3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому, в отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы, В современных установках используют платиновые катализаторы в виде пакета сеток из сплава платины с 7,5% родия, или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III). Введение родия повышает механическую прочность и уменьшает потери платины за счет ее уноса током газа. Поверхность подобных катализаторов достигает 1,5 м2/м3 объема.