Количественный анализ
Z - число эквивалентности = 2, так как для восстановления Cd из раствора потребуется 2 ē.
![]()
![]()
Ответ: I=0,25А.
№204
Сколько г хлора содержит исследуемый раствор NH4Cl, если на титрование его затрачено 30 мл раствора AgNO3, титр
которого по хлору равен 0,003512 г/мл?
Дано: Найти: m(Cl2) - ?
V(AgNO3) =30 мл
T(AgNO3/Cl) =0,003512 г/мл
NH4Cl – исследуемый раствор
Решение
Найдем массу Cl2 согласно формуле:
![]()
![]()
m(Cl2)= T(AgNO3/Cl) ∙ V(AgNO3) = 30 мл ∙ 0,003512 г/мл=0,1054 г.
Ответ: m(Cl2) =0,1054 г.
№ 231
К раствору 0,226 г вещества содержащего хлор, прибавили 30 мл раствора AgNO3 концентрацией 0,1120 моль/л, а затем избыток серебра оттитровали 0,5 мл раствора NH4Cl. Рассчитать процентное содержание хлора в растворе.
Дано: Найти: W(Сl2)=?%
m(р-ра)=0,226 г
V(AgNO3) =30 мл
V(NH4Cl) = 0,5 мл
c=0,1120 моль/л
Решение
1. Из условий задачи видно, что определение велось методом обратного титрования (по остатку). Уравнения титрования:
1.Cl2+2AgNO3→2AgCl↓+2NO3 –
n(1/2Cl2)= n(AgNO3)
2. AgNO3+NH4Cl→AgCl↓+NH4NO3
n(NH4Cl)= n(AgNO3)
![]()
![]()
Найдем n(NH4Cl) = ![]()
Найдем n(AgNO3) = 0.03 л ∙0,1120 моль/л=0,0034 моль
Найдем массу Сl-
![]()
Найдем массовую долю хлора:
![]()
Ответ: W(Сl-)=0.08%.
№177
К 3750 мл раствора HNO3 c Т=0,005601 г/мл добавлено 3 мл HNO3 плотностью 1,395. Чему равны Н,Т и поправочный коэффициент в расчете на раствор концентрации 0,1 моль/л?
Дано: Найти: Н=?, Т=?, k=?.
V1(HNO3)=3750 мл
T(HNO3)=0,005601 г/мл
V2(HNO3)=3 мл
ρ=1,395 г/см3
c(HNO3)= 0,1 моль/л
Решение
1. Найдем титр полученного раствора с концентрацией 0,1 моль/л.
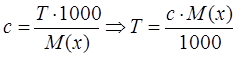
![]()
2. Найдем нормальность раствора HNO3.
![]()
3. Найдем поправочный коэффициент k.
Для этого рассчитаем массу HNO3 в исходном растворе HNO3 и в добавленном.
m1= ρ∙V=1,395г/мл∙3мл=4,185 г.
m2= Т∙V=0,005601 г/мл∙3750 мл=21,00375 г.
mобщ. =4,185 г+21,00375 г=25,1888 г.
Vобщ. 3750 мл+3 мл=3753 мл.
Найдем Трасч
![]()
![]()
Ответ:Н=0,1 моль/л; Т=0,0063 г/мл; k=0,94.
Другие рефераты на тему «Химия»:
- Развитие периодического закона. Зависимость свойства элементов от ядра его атома
- Синтез глицерина
- Синтез высококачественных прекурсоров и определение термической стабильности нанокомпозиций на основе ZrO2
- Ароматические ацетаминопроизводные
- Синтез диэтилового эфира малоновой кислоты. Свойства и основные методы получения сложных эфиров
