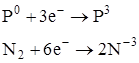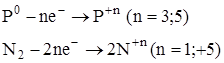Формирование у учеников ответственного отношения к учебе в процессе самостоятельной работы
|
Химические свойства На основе повседневных наблюдений скажите о химической активности нітрогену и фосфора. Выясняется, что азот малоактивен. Подтверждением этого является отсутствие взаимодействия в обычных условиях атмосферного азота с кислородом. Это объясняется прочностью химиче ских связей в его молекуле. При высоких температурах связки между атомами ослаблюються и нітроген становится реакційноздатним. Да, например, при температуре электрической дуги нітроген реагирует с кислородом: |
запись на доске |
|
Такая реакция происходит и при электрических разрядах в атмосфере во время грозы. При определенных условиях нітроген реагирует с водородом: |
запись на доске |
|
При повышенной температуре реагирует с некоторыми металлами, например: |
запись на доске |
|
Если долго нагревать белый фосфор без доступа воздуха, то он желтеет и постепенно превращается в красный фосфор. При нагревании красного фосфора в таких же условиях он превращается в пару, в результате конденсации которой образуется белый фосфор. Белый фосфор химически очень активен. Вступает в реакцию с кислородом уже при температуре 40єС (занимается), и образуется окисел фосфора (V):
| |
|
Красный фосфор реагирует с кислородом аналогично, но реакция начинается только при 260єС. |
|
Фосфор образует также соединения с водородом – фосфін РН3 2Р + 3Н2 = 2РН3 Молекула цієї сполуки за своєю формою схожа на аміак, але менш стійка. Фосфор реагує з багатьма металами і утворює фосфіди, наприклад, фосфід кальцію Ca3P2 |
ІІІ. Задание: самостоятельно проработайте применение нітрогену и фосфора.
Вариант А. До соответствующих колонок таблицы запишите уравнение реакций, какие бы иллюстрировали эти свойства. Составьте электронный баланс. Укажите названия продуктов реакции.
Химические свойства нітрогену и фосфора.
|
N2, P - окислители |
N2, P - восстановители |
|
|
|
|
1. Взаимодействие с Ме
2. Взаимодействие с Н2
|
1. Взаимодействие с nMe (с большей электронной гамивністю)
|
2. Вычислить массовую частицу нітрогену в его высшем окисле.
Вариант В. 1. Охарактеризуйте химические элементы N и А за их положением в периодической системе.
|
нітроген |
фосфор | |
|
1. Положение в периодической системе | ||
|
2. Строение атома | ||
|
3. Возможные степени окисления | ||
|
4. Возможные валентности |
2. Закончить уравнение реакций:
а) ![]() ; б)
; б) ![]() ; в)
; в) ![]() ; г)
; г) ![]() .
.
Вариант С. 1. Записать молекулярную, структурную и электронную формулы азота.
3. Реакция между азотом и водородом изображается таким термохимическим уравнением:
![]() кДж.
кДж.
Объяснить, в какую сторону и почему произойдет смещение равновесия: а) при увеличении давления; бы) при повышении температуры.
Контролирующая часть модулю.
IV. Вариант А. 1. Запишите уравнение реакций таких превращений:
![]()
2. При нагревании технического нитрата меди (ІІ) массой 75,2г, выделяется кислород объемом 4л (н.у.). Рассчитайте массовую частицу примесей в образце нитрата.
3. Укажите уравнение окислительно-восстановительных реакций:
а) 2PH3 + 4O2 = P2O5 + 3H2O;
б) P2O5 + H2O = 2HPO3;
в) 4H3PO3 = 3H3PO4 + PH3;
г) Ca3P2 + 6HCl = 3CaCl2 + 2PH3;
д) PCl3 + 3H2O = H3PO3 + 3HCl.
Вариант В. 1. Густоту нітрогену определенно за воздухом. Какой формулой следует пользоваться для вычисления его молекулярной массы:
а) М = 28Д; в) М = 32Д;
б) М = 29Д; г) М = 44Д?
2.Сколько окисла фосфора (V) образуется во время сжигания 62кг фосфора:
а) 284кг; бы) 142кг; в) 71кг; г) 2кг?
3. Физические свойства нітрогену и фосфора.
Вариант С. 1. Дописать уравнение, если реакция возможна. Отметив условие хода каждой из них:
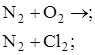
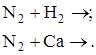
2. Чем отличается строение амонів изотопов азота ![]() ?
?
3. Укажите правильное размещение электронов в энергетических амбарчиках и электронную формулу атома азота:
а) 1s2 2s2 2p3 ; бы) 1s2 2s2 2p6 3s 2 3p3 ;
в)
|
|
Другие рефераты на тему «Педагогика»:
- Проверка и оценка уровня знаний учащихся в процессе обучения географии
- Звуковая сторона речи
- Воспитание этической культуры у младших школьников
- Интегрированный урок биологии и химии на тему "Структурная организация живой клетки"
- Развитие творческих способностей дошкольников в музыкальной деятельности
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения