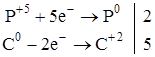Формирование у учеников ответственного отношения к учебе в процессе самостоятельной работы
Проанализировав возможности технологии модульно-рейтинговой учебы, мы пришли к выводу, что данная технология учебы позволяет индивидуализировать учебно-воспитательный процесс: содержанием учебы; темпом усвоения знаний и формирования умений; стилем деятельности; контролем и самоконтролем; характером педагогической взаимодействует учителя и учеников.
Внедрение описанной методики организации и
оценивания самостоятельной работы способствует повышению самостоятельности, ответственность за результаты своего труда, что влияет на выбор будущей профессии, дает возможность создать условия для самореализации учеников, проявления их индивидуальных способностей, стимулирует творческую работу в течение четверти, индивидуализирует процесс учебы во всех формах учебной деятельности.
1. Традиционная технология учебы, которая является основой в современной общеобразовательной школе и базируется на информационной модели образования, теряет свою актуальность. Ведь в эпоху научно-технической революции объем учебной информации удваивается каждые 10 лет и ставить целью усвоение всей информации становится нецелесообразным. На первое место выступает задание развития личности ученика, который становится субъектом учебно-воспитательного процесса.
2. Задание развития особенности ребенка призванные выполнить новые технологии учебы, основным ориентиром которых является ученик, как уникальная и неповторимая личность.
3. Основным методом учебы становится не передача готовой информации от учителя к ученику, а самостоятельная учебная деятельность учеников.
4. Под самостоятельной работой мы понимаем такую форму организации процесса учебы, которая осуществляется с целью приобретения новых знаний и умений в отведенное время без непосредственного участия учителя, но под его руководством.
5. Основными условиями эффективного применения самостоятельных работ являются: а) технологизация учебного процесса; бы) создание базы дидактичного материала для систематической самостоятельной учебно-познавательной деятельности учеников; в) гармонизация индивидуальной, групповой и фронтальной форм самостоятельной работы; г) доминирование творческих учебно-познавательных заданий над репродуктивными в процессе самостоятельной работы учеников.
6. В процессе экспериментальной работы обнаружено, что эффективной технологией учебы, которая ставит целью развитие личности ученика и формирования самостоятельности, как черты характера, есть технология модульно-рейтинговой учебы.
7. Под технологией модульно-рейтинговой учебы мы понимаем такую технологию организации учебно-воспитательного процесса, что базируется на индивидуализации и дифференциации учебы, обеспечивает стимулирующую и развивающую функции полученных знаний, их самостоятельность и мобильность в процессе учебы.
8. Использование самостоятельной дифференцированной работы учеников в технологии модульно-рейтинговой учебы дает возможность индивидуального процесса учебы и ставит учеников в условие свободного выбора содержания химического образования, методов и темпов учебы.
9. Результаты педагогического эксперимента подтвердили эффективность применения технологии модульно-рейтинговой учебы, которая берет за основу самостоятельную работу учеников. Ведь 21,4% учеников экспериментального класса обнаружили знание на уровне оценки “5”, 53,6% - “4”, 25% - “3”, тогда как в традиционной технолгії эти показатели составляют: 13,8% - “5”, 48,3% - “4”, 37,9 – “3”.
Мини-модуль
Тема: Нітроген и фосфор. Физические и химические свойства нітрогену и фосфора.
Цель: образовательная:
воспитательная: формировать у учеников самостоятельность, как черту личности.
развивающая: развивать умение самостоятельно работать с литературой, логично мыслить, делать обобщения, сравнения, выводы.
Методы и приемы: беседа, рассказ, демонстрация, самостоятельная работа с литературой.
Оборудование: таблица “Строение молекулы нітрогену и фосфора”.
План урока.
І. Організаційни момент.
ІІ. Ознакомление с основными понятиями темы.
ІІІ. Самостоятельная работа с учебником да дополнительной литературой.
IV. Выполнение контролирующих завань.
V. Подведение итогов урока.
VІ. Т’юторски задание, их инструктаж.
|
ІІ. Строение молекулы N и P. Молекула нітрогену состоит из двух атомов, химическая формула N2, структурная формула N º N, электронная формула |
запись на доске | |||||
|
Согласно с учением об образовании ковалентной химической связи перкриванням электронных туч в молекуле нітрогену образуется один -зв’язок и два p-зв’язки. У вільному стані фосфор утворює кілька алотропних видозмін. Це пояснюється тим, що атоми фосфору здатні взаємносполучатись, утворювати кристалічні решітки різного типу. |
таблиця | |||||
|
Как и у нітрогену атомы фосфора образуют три ковалентных связки, но в отличие от него атомы фосфора попарно связаны только одной ковалентной связью. Две единицы валентности, которая осталась, используются для присоединения третьего и четвертого атомов фосфора. В зависимости от того, как происходит присоединение третьего и четвертого атомов фосфора, образуется или молекулярная или атомная кристаллическая решетка. |
таблиця | |||||
|
Нахождение в природе. Нітроген содержится в воздухе в свободном состоянии (»78% по объему). Небольшое его количество в виде нитратов содержится в почве. Он является составной частью белковых веществ. Поскольку фосфор очень химически активен, то вприроді он существует лишь в соединениях. Важнейшие минералы, которые содержат фосфор, - это фосфорить и апатит. К их составу входит ортофосфат кальция Ca3(PO4)2. Фосфор входит в состав некоторых белковых веществ, которые содержатся в генеративных органах растений, в нервных и костных тканях организмов животных и человека. Особенно богатые на фосфор мозговые клетки. | ||||||
|
Добывание. Для технических потребностей азот выделяют из воздуха на тех же установках, что и кислород. Чистый азот добывают разложением некоторых его соединений.
Фосфор добывают с фосфоритів и апатитом, нагревая их в электрической печи без доступа воздуха в присутствии SiO2 и уголь:
Пара фосфора конденсирующаяся над водой, и при этом образуется белый фосфор. | ||||||
|
Физические свойства | ||||||
|
Характеристика вещества |
Свойства N |
Свойства Р | ||||
|
белого |
красного | |||||
|
Физическое состояние |
газ |
кристалічна речовина |
порошкоподібна речовина | |||
|
Твердость |
-- |
небольшая – можно резать ножом (под водой) |
-- | |||
|
Цвет |
бесцветный |
бесцветный с желтоватым оттенком |
темночервоний | |||
|
Запах |
без запаха |
чесноковый |
без запаха | |||
|
Густота (г/см3) |
28 |
1,8 |
2,3 | |||
|
Растворимость в воде |
малорастворимый |
нерастворимый |
нерастворимый | |||
|
Температура плавления (єС)_Свечение |
-- |
в темноте светится |
не светится | |||
|
Действие на организм |
сильный яд |
неядовитый | ||||
Другие рефераты на тему «Педагогика»:
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения