Роль современного урока химии в формировании научного мировоззрения учащихся
Пример 3.2.3. Растворимость бромата серебра AgBrO3 (в г на 100 г воды) в интервале температур от 5 – 800С подчиняется уравнению:
![]() . (2.3.)
. (2.3.)
К насыщенному раствору AgBrO3, массой m1 = 1кг, взятому при температуре t1 = 800C прибавили чистого льда массой m2 = 100 г и температурой t2 = 00C. Будет ли образовываться осадок AgBrO3
после выравнивания температуры? Теплоемкостью сосуда, где проводится опыт, пренебречь.
Решение:
Рассчитываем массу AgBrO3 в растворе.
Подставляя в уравнение (2.3.) температуру раствора найдем его растворимость: S1 = 0,93 (г на 100 г воды). Отсюда находим содержание растворенного вещества в исходном растворе по уравнению ![]() .
.
Составим уравнение теплового баланса для данной системы:
![]()
учтем, что tл = 00С и решим уравнение относительно tx, получаем:
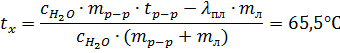
По формуле (2.3.) находим растворимость AgBrO3 при данной температуре. Sx = 0,641 (г на 100 г воды). Тогда mx’ = 7,05 (г).
Заключаем, что m’1 > m’x. Следовательно, осадок выпадет.
Ответ: осадок выпадет.
Пример 2.2.4. Растворимость карбоната лития Li2CO3 (в г на 100 г воды) в интервале температур от 0 – 750С подчиняется уравнению
![]() (2.4)
(2.4)
К насыщенному раствору Li2CO3, масса которого равна m1=500 г взятому при температуре t1 = 700C прибавили чистого льда массой m2 = 100 г и температурой t2 = 00C. Будет ли образовываться осадок Li2CO3 после выравнивания температуры? Теплоемкостью сосуда, где проводится опыт, пренебречь.
Решение аналогичное примеру 3.3.
Ответ: осадок выпадет.
Пример 2.2.5. Растворимость гидроксида кальция Ca(OH)2 (в г на 100 г воды) в интервале температур от 15 – 800С подчиняется уравнению:
![]() (2.5.)
(2.5.)
К насыщенному раствору, масса которого равна m1=700 г, взятому при температуре t1 = 800C прибавили чистого льда массой m2 = 50 г и температурой t2 = 00C. Возможно ли образование осадка Ca(OH)2 после выравнивания температуры? Теплоемкостью сосуда, где проводится опыт, пренебречь.
Решение аналогичное примеру 3.3.
Ответ: осадок выпадет.
Немалые возможности может дать «Электролиз водных растворов и расплавов», тем более что в школьном курсе эта тема представлена слабо. Варианты развития темы: вывод формулы вещества, подвергнувшегося электролизу; расчеты масс веществ образовавшихся (разложившихся) при электролизе, если на аноде или катоде протекало сразу две реакции.
Пример 2.2.6. Синтез Кольбе - это анодное окисление аниона карбоновой кислоты на инертном материале, в результате чего образуется предельный углеводород; например,
2CH3COO– ® C2H6 + 2CO2 + 2e–.
Раствор ацетата натрия подвергли электролизу током 2 А в течение 4 час. На инертном аноде выделилось смесь газов объем, которой при р = 1 бар и t = 30оС, составил 4,25 л. Какая часть анодного заряда затрачена на окисление воды?
Решение:
Общее количество вещества газов:
n = pV/RT = 0,169 моль.
Электрический заряд, участвующий в электролизе:
Q = It = 2,88.104 Кл.
Помимо синтеза Кольбе, на аноде протекало окисление воды:
2H2O → O2 + 4H+ + 4e-.
Пусть на этот процесс затрачено х Кл, тогда на синтез Кольбе будет израсходовано (2,88·104 – х) Кл. Перейдем от электрических зарядов к количеству вещества e-, поделив заряды на постоянную Фарадея:
υ1 = x/F моль
и
υ2 = (2,88·104 – х)/F моль.
Из стехиометрии анодных процессов следует, что
υ(О2) = 1/4υ1 = x/4F моль,
υ(С2Н6) +υ(СО2) = 3/2υ2 = 3. (2,88·104 – х)/2F моль.
Уравнение на х:
x/4F + 3. (2,88·104 – х)/2F = 0,169,
откуда х = 2,15.104 Кл.
Искомая величина:
x/Q = 0,75.
Ответ: 75 %.
Развитие демонстрационного эксперимента
Широкие возможности для развития школьного демонстрационного эксперимента предоставляет электрический ток. С его помощью можно:
а) Получать в микроколичествах простые вещества: водород, кислород, хлор, бром, йод, некоторые металлы;
б) Наблюдать миграцию окрашенных ионов в тонких слоях растворов электролитов или на фильтровальной бумаге, смоченной «фоновым» раствором;
в) Используя универсальную индикаторную бумагу, демонстрировать реакцию нейтрализации кислоты щелочью;
г) При целенаправленной встрече определенных ионов наблюдать ряд цветных реакций;
е) Показывать отличие вещества-электролита от неэлектролита, сильного электролита от слабого (по электропроводности);
ж) Демонстрировать изменение рН прикатодной и прианодной областей раствора электролита в процессе его электролиза.
Фоточувствительный слой черно-белой негативной фотопленки может стать удобным материалом для демонстрации:
а) Зависимости скорости химической реакции от концентрации реагента (на примере процесса проявления или фиксирования фотослоя);
б) Зависимости скорости реакции от температуры (на примере тех же процессов);
в) Влияние кислотности среды на скорость реакции (на примере проявления фотослоя).
Порошковая сера, добавленная в реакционную среду «металл/ кислота», может дать информацию о том, какой водород выделяется при саморастворении металла: атомарный или молекулярный (по запаху).
Интерпретация некоторых положений химии
Развитие темы «Почему «царская водка» растворяет золото». Хорошо известно, что компоненты «царской водки» – НСl и НNO3 – на него не действуют. Основа развития – окислительная способность ионов NO3– и комплексообразование ионов Au3+ c ионами Сl–.
Развитие темы «Растворение металлов в азотной кислоте». Можно сделать попытку интерпретировать восстановление азотной кислоты до NO2, NO, N2O, N2, NH3,… на основе коррозионных диаграмм. Глубина восстановления HNO3 будет тем больше, чем ниже потенциал саморастворения металла. На основе этого принципа, быть может, удастся объяснить связь природы металла, концентрации кислоты и температуры с продуктами восстановления азотной кислоты. Есть основания предполагать, что при определенных условиях азотная кислота может окислять металл ионами водорода.
Развитие темы «Влияние температуры на скорость реакции». Основа развития – распределение Максвелла-Больцмана для скоростей молекул идеального газа. С повышением температуры доля «горячих» молекул быстро растет, что способствует ускорению химического процесса.
Развитие темы (с привлечением эксперимента) «Растворение меди в соляной кислоте». Медь растворяется в «дымящей» HCl, хотя в ряду напряжений металлов она расположена за водородом. Основа интерпретации – комплексообразование ионов Cu+ с ионами Сl–.
В ходе данной работы были разработаны методические рекомендации, использование которых, в школьном курсе химии, способствует более полному представлению у учащихся химии как науки. Предполагается что предоставленные научно-методические идеи способствуют профессиональной ориентации школьного поколения.
Другие рефераты на тему «Педагогика»:
- Выявление взаимосвязи трудоспособности и самооценки у детей младшего школьного возраста
- Методика преподавания познания мира
- Развитие коммуникативных умений у старших подростков
- Создание тестов с помощью программы MyTest и их применение на различных предметах в школьной программе
- Социально-педагогическая деятельность по профилактике склонности воровства у детей младшем школьном возрасте
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
