Роль современного урока химии в формировании научного мировоззрения учащихся
Условие полета шарика (закон Архимеда):
![]()
Или
![]() ,
,
Откуда х > 8,26 гр. Поскольку х > 9 гр, первое условие выглядит корректным.
Пусть вода взята в избытке, тогда весь гидрид лития реагирует. При этом
n(H2)= n(LiH) = 0,5 моль. объем шарика п
ри н. у.:
![]()
Масса воздуха, вытолкнутого шариком:
![]()
Условие полета шарика:
![]() ,
,
где х – по-прежнему масса воды. Из этого неравенстве находим:
![]()
Масса воды больше 9 гр, то есть и второе условие корректное.
Ответ: 8,26 гр < m(H2O) < 9,45 гр.
Разработка задач нового поколения
Большие возможности для разработки задач нового поколения дает направление, связанное с расчетом масс и массовых долей электронов в веществе. Несколько шагов на этом пути уже сделано [29]. Построение такого класса задач основано на том, что массовая доля электронов наибольшая в водороде (главный изотопный нуклид 1Н не содержит нейтронов) и она постепенно уменьшается по мере увеличения порядкового номера химического элемента из-за прогрессирующего роста числа нейтронов в ядре. Например, в ядре атома фтора – 9 протонов и 10 нейтронов, поэтому массовая доля электронов здесь намного ниже, чем в атомах 1Н.

Рис. 2.2. Иллюстрация зависимости для смеси двух веществ заданного состава.
Те же возможности предоставляет набор изотопов водорода. Понятно, что переход от протия 1Н к дейтерию 2Н, а тем более к тритию 3Н снижает массовую долю электронов соответственно в 2 и в 3 раза.
Пример2.2.1. Массовая доля электронов в смеси газообразных протия ![]() и дейтерия
и дейтерия ![]() составляет 4,064.10–4. Какова молярная масса этой смеси? Каково содержание протия в смеси?
составляет 4,064.10–4. Какова молярная масса этой смеси? Каково содержание протия в смеси?
Решение:
Выберем массу смеси, равную, а г. Пусть массовая доля ![]() будет ω, тогда доля
будет ω, тогда доля ![]() будет (1-ω). Следовательно, масса
будет (1-ω). Следовательно, масса ![]() равна, аω г, а масса
равна, аω г, а масса ![]() – а(1-ω) г. Формула для расчета массовой доли электронов в молекуле протия имеет следующий вид:
– а(1-ω) г. Формула для расчета массовой доли электронов в молекуле протия имеет следующий вид:
![]()
![]() 5,486·10-4 – относительная электронная масса.
5,486·10-4 – относительная электронная масса.
Рассчитаем массовую долю электронов в молекуле протия:
![]()
Массовая доля электронов в молекуле дейтерия:
![]()
Масса электрона в ![]()
![]() г;
г;
масса электрона в ![]() :
:
![]()
Массовая доля электронов в смеси газов будет рассчитываться по формуле:
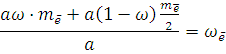
Или
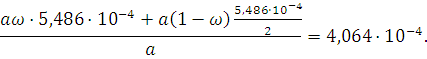
Из последнего уравнения находим ω=0,48. Вычислим молярную долю ![]() в смеси:
в смеси:
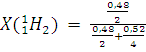 = 0,65.
= 0,65.
Молярная масса смеси газов:
![]()
Или
![]()
Ответ: 2,7 г/моль; 0,65 (мольная доля).
Как вариант развития предлагаемого направления могут быть разработаны задачи, требующие расчета массовых долей нейтронов или протонов в веществе. Идея конструкции условия задачи та же: по мере роста порядкового номера химического элемента массовая доля протонов падает, а нейтронов повышается.
Другое направление – развитие заданий, основа которых состоит в расчете дефекта массы по уравнению Эйнштейна E = mc2. Понятно, что здесь должны рассматриваться ядерные реакции и зависимость энергии упаковки нуклонов от массового числа нуклида. Последняя информация доступна, она может быть найдена в соответствующих справочниках. Шаг в этом направлении сделан в.
Пример 2.2.2. Рассчитайте точное значение атомной единицы массы на основе значений масс протона, нейтрона, электрона и энергии упаковки нуклонов в ядро углерода-12. Сравните полученную величину с точным значением: 1 а.е.м. = 1,66056.10–27 кг. Какая величина не учтена нами при вычислениях?
Решение:
По определению
![]()
Это табличное значение.
Для того, чтобы решить эту задачу необходимы некоторые справочные данные, такие как:
Масса протона: mp = 1,672622·10-27 кг;
Масса нейтрона: mn = 1,674927·10-27 кг;
Масса электрона: me = 9,10938·10-31 кг.
Масса атома углерода без учета дефекта массы:
![]()
Энергия упаковки нуклонов в ядро атома углерода приблизительно равна:
![]()
Полная энергия упаковки в ядре атома углерода равна:
![]()
Дефекты массы ядра:
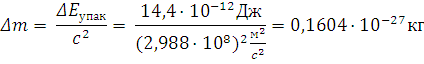
Масса атома углерода с учетом дефекта массы:
![]()
Отсюда можем найти 1а.е.м.:
![]()
Это несколько больше табличного значения. Причинами этого служат:
Приближенное значение энергии упаковки нуклонов;
Не учтено, что при соединении 6e- с ядрами тоже происходит дефект массы.
Ответ: 1,66086·10-27кг.
В школьном курсе физики изучается понятие теплоемкости вещества. Есть на эту тему и некоторое количество физических задач. Однако школьная химия этим понятием не пользуется. Для развития межпредметных связей есть возможность и целесообразность включения этого понятия и в химические задачи. В этом направлении тоже сделан один шаг.
Удельная теплоемкость – физическая величина, численно равная количеству теплоты, которое необходимо сообщить телу для того, чтобы изменить его температуру на 10С, при том, что масса этого тела 1 кг.
Другие рефераты на тему «Педагогика»:
- Проблема самообразования в зарубежной педагогической науке
- Деятельность социального педагога по предупреждению суицидального поведения у подростков
- Проблемы обучения детей на занятиях в условиях разновозрастной группы
- Взаимосвязь особенностей восприятия и дисграфических расстройств у детей с нарушениями зрения
- Формирование основ экологической культуры у старших дошкольников средствами игровой деятельности
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
