Роль современного урока химии в формировании научного мировоззрения учащихся
Развитие математических методов в химии
В специализированных химических классах приемлемо шире использовать графические методы. Они наглядно демонстрируют, почему предлагаемая задача имеет единственное решение, в каком случае этих решений будет множество или, наоборот, решение невозможно.
Пример 2.1.1. Смесь магния с цинком массой 10 г растворили в соляной кислоте. В реакции выделилось
5,51 л водорода (н.у.). Сколько г цинка содержала смесь?
Решение:
Запишем уравнения реакций взаимодействия металлов с кислотой:
Mg+2HCl→MgCl2+H2 (2.1);
Zn+2HCl→MgCl2+H2 (2.2).
Предположим, что в смеси содержится 10 г Mg, тогда в данной смеси веществ будет протекать только реакция (2.1). Зная молярную массу металла и значение молярного объема одного моль вещества, находим объем водорода выделившегося в результате этой реакции. Составим пропорцию:
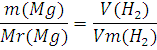
Или
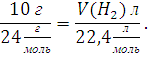
Решив, пропорцию получается ответ 9,33 л водорода выделилось бы в том случает если бы в смеси металлов было 10 г магния. Это противоречит данному условию задачи, так как объем выделившегося газа меньше чем 9,33 литра.
Предположим, что в смеси содержится 10 г цинка, тогда в данной смеси веществ будет протекать только реакция (2.2). Аналогично предыдущему примеру рассчитаем объём выделившегося водорода в результате протекания реакции (2.2). Составим пропорцию:
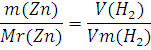
Или
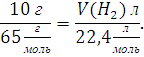
Проведя расчеты, мы получаем следующий ответ: 3,45 л водорода выделиться, если в смеси будет содержаться 10 г цинка и 0 г магния. Данный ответ снова противоречит условию задачи.
Объём выделившегося газа по условию задачи это среднее значение между двумя крайними случаями рассмотренными выше:
3,45л(10г Zn+0г Mg)<5,51(xг Zn+ у г Mg)<9,33(0г Zn+ 10г Mg).
Данную задачу можно решить следующим графическим способом:
|
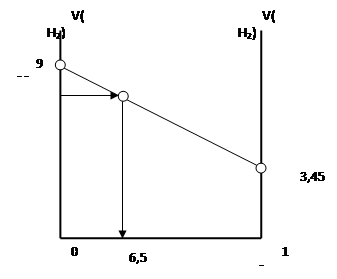
Рис.2.1. Диаграмма зависимости смеси металлов от объёма выделявшегося газа
Горизонтальную линию диаграммы обозначаем как шкалу массы металла цинка, а вертикальная линия – шкала объёма выделявшегося газа. Точка на левой шкале объёма выделившегося водорода отвечает такому составу смеси, в которой содержаться 10 г магния и 0 г цинка, а точка на правой шкале - отвечает противоположному составу смеси. Соединив эти точки, мы получим прямую, которая указывает на зависимость состава смеси металлов от объема выделившегося газа в данной системе. В областях находящихся выше и ниже данной прямой данная задача физического смысла не имеет, а наклон прямой указывает на то, что данная зада имеет только одно решение.
По условию задачи известно, что объём газа составляет 5,51 л, найдя на вертикальной шкале данное значение, проводим перпендикуляр от точки до пересечения с кривой, а затем опускаем перпендикуляр на шкалу масс.
Ответ: 6,5 г.
Мы предлагаем при решении некоторых задач использовать метод ненормированных массовых, молярных и объемных долей. Этот метод может быть успешно использован в математических классах. Нормированные доли в сумме равны единице. Однако иногда удобно использовать и ненормированные доли, сумма которых единице не равна.
Пример 2.1.2. В смеси веществ А, В и С массой 50 г массовые доли равны: wА = 0,250, wВ = 0,450 и wС = 0,300. К смеси прибавили 15 г вещества D. Каковы массовые доли компонентов в образовавшейся смеси?
Решение:
В условии задачи указаны нормированные массовые доли:
0,250 + 0,450 + 0,300 = 1.
Прибавление вещества D уменьшает wА, wВ и wС, поэтому доли теряют свойство нормированности, однако отношение между долями остается прежним.
Массовая доля вещества D равна wD = 15/65 = 0,231. Учитывая, что отношение чисел 0,250, 0,450 и 0,300 в новой смеси остается прежним, запишем условие нормировки старых долей:
wD + k(wА + wВ + wС) = 1,
Или
0,231 + k(0,250 + 0,450 + 0,300) = 1.
Из уравнения находим нормировочный коэффициент: k = 0,769. Умножая его на wА, wВ и wС, получим нормированные искомые величины: wА = 0,192; wВ = 0,346; wС = 0,231; wD = 0,231. Легко проверить, что вычисленные wi являются нормированными долями.
Ответ: wА = 0,192; wВ = 0,346; wС = 0,231; wD = 0,231.
Школьная химия практически не использует квадратные уравнения. Однако химические задачи, решаемые с помощью квадратных уравнений, весьма необычны. Составление же квадратных уравнений требует от ученика определенной математической культуры.
На кафедре физической химии сделано несколько шагов в этом направлении [28].
Пример 2.1.3. При взаимодействии 25,7 г металла с кислотой выделился водород, объем которого при н.у., измеренный в литрах, оказался численно равным молярной массе этого металла, выраженной в г/моль. Определите этот металл.
Решение:
Запишем схему реакции:
Ме + НА → МеА + Н2.
По закону эквивалентов можно записать следующую пропорцию:
![]()
Молярная масса металла, из условия, и объёма выделившегося водорода в результате взаимодействия веществ численно равны. Обозначим эти величины за x и выразим неизвестное:
![]()
Находим значение x=23,99. Объем выделившегося водорода приблизительно равен 24 л. Металл имеющий молярную массу равной 24 г/моль – магний.
Ответ: металл Mg.
Возможно использование аппарата алгебраических неравенств. Задачи, решение которых требует обращения к аппарату неравенств, под силу ученикам с высоким уровнем математической культуры. Особенна и интерпретация решения этих задач, т. к. решение обычно заключено в определенных числовых пределах.
Пример 2.1.4. В оболочку воздушного шарика массой 1 г поместили 4 г гидрида лития и воду. Шарик немедленно герметизировали. Какова должна быть масса воды, чтобы шарик полетел? Опыт проводится при н. у. Считать, что давление внутри шарика равно атмосферному.
Решение:
Запишем реакцию взаимодействия воды и гидрида натрия:
LiH + H2O = LiOH + H2↑.
Пусть вода взята в недостаточном количестве, то есть полностью реагирует с гидридом лития. Поскольку n(LiH) = 0,5 моль, то и n(H2O) < 0,5 моль, или m(H2O) < 9 гр. При этом
![]()
где х – масса взятой воды (х<9 гр). Объем шарика при н. у.:
![]()
Масса воздуха вытолкнутого шариком:
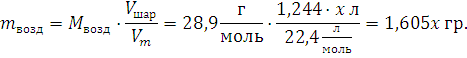
Другие рефераты на тему «Педагогика»:
- Формирование социальной адаптации детей дошкольного возраста с синдромом Дауна
- Чтение как познавательный процесс и роль учителя в нем
- Реализация социальным педагогом психотерапевтических методов по формированию навыков общения и снижению уровня застенчивости, пассивности младших школьников
- Организация групповой работы на уроках
- Состояние и перспективы развития общего образования в России
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
