Загрязнение окружающей среды промышленными предприятиями и защита от загрязнения
Технологический процесс (рис. 4, а) включает стадии сушки гипса, размола добавок и подготовки сырья для обжига (сухой способ). В процессе обжига шихты при температуре до 1400–1450 °С идет восстановление сульфата кальция коксом и образование клинкера. Присутствующие в шихте песок и глина способствуют интенсификации протекающей при обжиге конверсии сульфата кальция. В качестве топлива для обжигов
ой печи используют мазут, газ или распыленный уголь. Получающийся клинкер размалывают.
Горячий газ, содержащий диоксид серы, очищают в циклонах и электрофильтрах и подают на сернокислотную установку. На получение 1 т 98%-ной серной кислоты (для типовой установки производительностью 1000 т/сут) расходуется 1,6 т фосфоангидрита, 0,14 т глины, 0,08 т песка, 0,11 т кокса, 85 м3 воды, 160 кВт‑ч электроэнергии и 6,3 ГДж (1,5–106 ккал) топлива.
Реакция разложения СаSO4 в присутствии восстановителя протекает в две стадии. На первой стадии образуются сульфид кальция и диоксид углерода (частично и СО):
СаSО4 + 2С ® СаS + 2СО2. (1)
Вторая стадия может быть представлена двумя параллельными процессами:
СаS + 3СаSO4 ® 4СаО + 4SО2, СаS + 2SО2 ® СаSО4 + S2. (2)
При 900 °С скорости этих процессов близки, а при более высокой температуре преобладает первый из них. Процесс сопровождается побочными реакциями и прямым термическим разложением фосфоангидрита (при 1100 °С достигает 5%). На побочные реакции расходуется углерод, поэтому его берут с избытком по отношению к стехиометрическому количеству согласно суммарной реакции
2СаSО4 + С ® 2СаО + 2SО2 + СО2 (3)
Избыток углерода составляет 20% при переработке фосфоапгидрита, полученного при экстракции кислоты из фосфоритов, и 30%–в случае переработки апатитов. При больших избытках восстановителя получается слишком много сульфида кальция, при недостатке – велик процент неразложившегося сульфата кальция.
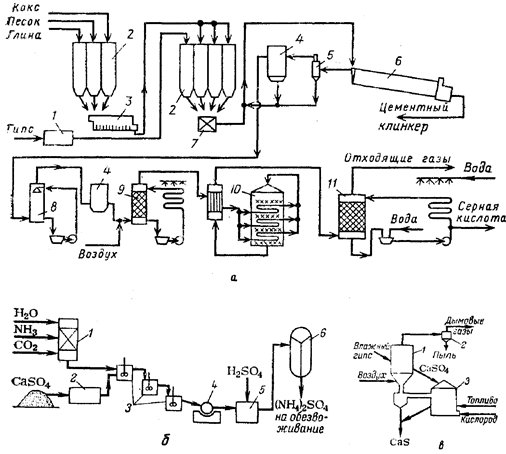
Рис. 4. Схемы утилизации отходов производства экстракционной фосфорной кислоты: а – при переработке фосфоангидрита в серную кислоту и цемент: 1 – сушилка; 2 – силосы; 3 – мельница; 4 – электрофильтры; 5 – циклон; 6 – вращающаяся печь; 7 – смеситель; 8 – холодильник; 9 – сушильная башня; 10 – конвертер; 11 – абсорбер; б – при переработке фосфогипса в сульфат аммония: 1‑реактор для приготовления (NH4)2СО3; 2 – мельница; 3 – реакторы двойного замещения; 4‑барабанный фильтр; 5 – реактор-нейтрализатор; 6 – многокорпусный выпарной аппарат; в-при переработке фосфогипса в сульфид кальция; 1‑реактор 1; 2 – циклон; 3 – реактор II
Процесс очень чувствителен к кислороду: при высоком его содержании в газе выгорает сера (СаS + 2О2 ® СаSО4), а образование сульфата кальция приводит к формированию в печи трудноудаляемых наростов, колец, сваров и настылей. Поэтому обжиг ведут при содержании в газовой фазе 0,5–0,6% кислорода. При 1200 °С в присутствии 20–30%-го избытка восстановителя получают газ концентрацией 10–13% SО2. Остаточное содержание серы в твердой фазе составляет 0,2–0,5%.
Установлено, что присутствие в сульфате кальция фосфатов (до 15% Р2О5) не влияет на процесс его диссоциации, но ухудшает образование и кристаллизацию силикатов кальция в цементном клинкере. Фтор, переходящий в процессе обжига фосфогипса в газовую фазу, отравляет катализатор процесса конверсии SО2 в SО3. Поэтому, хотя одновременное присутствие фосфатов и фтора способствует стабилизации фазы трехкальциевого силиката 3СаО • SO2, являющегося основным компонентом цементного клинкера, концентрация фтора и Р2О5 в фосфогипсе должна ограничиваться соответственно 0,15 и 0,5%.
Технико-экономические расчеты показывают, что себестоимость серной кислоты из фосфогипса в 1,4 раза выше, чем из флотационного колчедана, но может быть снижена при увеличении масштабов производства и его интенсификации.
На ряде зарубежных предприятий налажено производство сульфата аммония из фосфогипса. Процесс основан на взаимодействии фосфогипса и карбоната аммония (или NН3 и СО2) при атмосферном или повышенном давлении. Существуют два способа: жидкостный [СаSO4 + (NH4)2SО4 + СаСО3] и газовый [2NH3 + СО2 + Н2O + CaSO4 ® СаСО3+ (NН4)2SО4]. Жидкостной способ имеет ряд преимуществ, так как при его реализации легче обеспечить отвод тепла экзотермических реакций путем циркуляции свежего раствора (NH4)2СО3. Кроме того, образующиеся при газовом способе мелкие кристаллы СаСО3 плохо отфильтровываются и отмываются.
На рис. 4, б приведена принципиальная схема жидкостного способа. Раствор (NН4)2СО3 проходит серию реакторов, где взаимодействует с размолотым фосфогипсом. Менее растворимый СаСО3, образующийся в результате реакции, выпадает в осадок. Его фильтрованием отделяют от 35 – 40%-го раствора NH4НСO3, который нейтрализуют серной кислотой (для удаления избытка NН3) и концентрируют в многокорпусной выпарной установке. Полученные выпариванием кристаллы сульфата аммония после центрифугирования высушивают. Для получения 1 т сульфата аммония расходуется 1340 кг гипса, 340 кг СО2, 60 кг Н2SО4 и 260 кг NН3. Процесс экономически целесообразен при условии, что суточная производительность установки составляет не менее 300 т сульфата аммония.
Использование аммиака для производства сульфата аммония, получаемого в значительных количествах в качестве побочного продукта в таких крупнотоннажных производствах как коксохимическое, менее экономично, чем для производства более концентрированных и агрохимически ценных азотных удобрений. Однако проблема использования процесса конверсии фосфогипса в сульфат аммония может быть весьма актуальной в связи с развитием азотно-сернокислотных схем переработки природных фосфатов для получения сложных удобрений. Замена части серной кислоты на сульфат аммония в этих процессах дает определенную экономию и тем самым увеличивает эффективность производства сложных удобрений. Это обстоятельство может быть проиллюстрировано на примере суммарных реакций процесса переработки азотнокислотной вытяжки по сульфатному способу:
2Ca5(PO4)3F + 12HNO3 + 4H2SO4 ® 6Н3РО4 + 6Са(NO3)2 + 4СаSО4 + 2НF
6Н3РO4 + 6Са(NО3)2 + 4СаSО4 + 2НF + 13NН3 ®
® 12NH4NO3 + 5CaHPO4 + NH4H2PO4 + 4CaSO4 + CaF2
2Са5(РO4)3F + 12НNО3 + 4Н2SО4 + 13NH3 ®
® 12NH4NO3 + NH4Н2РO4 + 5СаНРО4 + 4СаSО4 + СаF2 (4)
При получении из фосфогипса 1 т сульфата аммония выделяется 760 кг высококачественного осажденного мела, который может быть использован для различных целей.
Переработка фосфогипса в сульфат аммония может быть организована и в более сложном варианте, предусматривающем прокалку осажденного мела с последующим растворением образующегося СаО путем его обработки растворами аммонийных солей и одновременным получением концентрата нерастворимых в них редкоземельных элементов. При этом насыщенный аммиаком раствор СаСl2 карбонизуют газами печей прокалки с целью регенерации NН4Сl, а повторно образующийся осадок СаСО3 вновь прокаливают с получением очищенного СаО, направляя газы прокалки на стадию карбонизации.
Другие рефераты на тему «Экология и охрана природы»:
Поиск рефератов
Последние рефераты раздела
- Влияние Чекмагушевского молочного завода на загрязнение вод реки Чебекей
- Влияние антропогенного фактора на загрязнение реки Ляля
- Киотский протокол - как механизм регулирования глобальных экологических проблем на международном уровне
- Лицензирование природопользования, деятельности в области охраны окружающей среды и обеспечения экологической безопасности
- Мировые тенденции развития ядерной технологии
- Негативные изменения состояния водного бассейна крупного города под влиянием деятельности человека
- Общественная экологическая экспертиза и экологический контроль
