Производство 1,2-дихлорэтана
Таблица 5.2. Материальный баланс реактора прямого хлорирование этилена
|
Приход |
Расход | ||||||
|
Компоненты |
|
|
% |
Компоненты |
|
|
% |
|
Технический этилен, в том числе: Этилен Пропилен Метан Этан Технический хлор, в том числе Хлор Вода Кислород |
4484,77 4481,2 0,3 1,23 2,3 11392,6 11288,6 0,033 104 |
160,17 160,04 0,007 0,07 0,07 160,46 159 0,002 3,25 |
27,88 72,12 |
ДХЭ-сырец, в том числе: ДХЭ ТХЭ ВХ ХЭ Остальные, в том числе: Хлористый водород Пропилен Метан Этан Вода Кислород |
15565 15254 311,3 15,56 15,56 193,3 85,4 0,3 1,23 2,3 0,033 104 |
157,2 154,1 3,2 0,24 0,24 5,85 1,2 0,007 0,07 0,07 0,002 3,25 |
94,73 1,17 |
|
ИТОГО: |
15873,7 |
100 |
ИТОГО: |
15873,7 |
100 | ||
6. Тепловой баланс
Уравнение теплового баланса в общем виде:
Q1 + Q2 + Q3 + Q4 + Q5 +Q6+ Qпот., [6]
где Q1, Q2, Q3, Q4 – тепловые потоки технического этилена, технического хлора азота и продуктов реакции соответственно, кВт;
Q5 – теплота экзотермических реакций;
Q6 – теплота, отводимая кипящим конденсатом, кВт;
Q пот. – теплопотери в окружающую среду, кВт
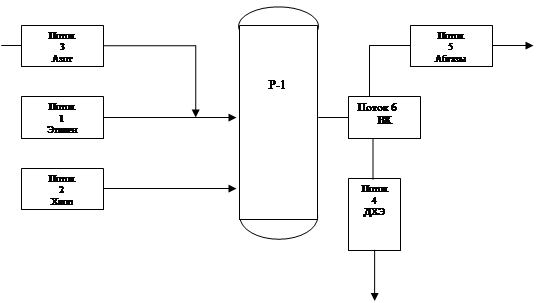
Исходные данные:
Материальные потоки (из таблицы материального баланса реактора)
Технический этилен: ![]()
Технический хлор: ![]()
Продукты реакции (ДХЭ – сырец): ![]()
Остальные: ![]()
Для расчета тепловых расчетов технического хлора, технического этилена, продуктов реакции рассчитаем средние молярные теплоемкости:
![]() [6]
[6]
технического хлора при температуре:
Т1=25+273=298К
технического этилена при температуре:
Т2=25+273=298К
продуктов реакции при температуре:
Т3=55+273=328К
остальных при температуре:
Т4=55+273=328К
Средние молярные теплоемкости
|
Наименование |
|
|
|
|
Технический этилен: Этилен Пропилен Метан Этан Итого: Технический хлор: Хлор Вода Кислород Итого: Остальные газы + продукты реакции: ДХЭ ТХЭ ВХ ХЭ Хлористый водород Пропилен Метан Этан Вода Кислород |
99,9 0,006 0,027 0,05 100 99,1 0,0003 0,9 100 97,3 1,28 0,004 0,004 1,34 0,001 0,01 0,038 0,0012 0,009 |
43,56 63,89 35,71 52,64 33,93 75,42 29,37 79,63 148,50 53,68 12,76 29,0 76,08 39,74 63,02 34,23 30,02 |
43,52 0,004 0,009 0,026 43,56 33,62 0,00023 0,264 33,88 77,48 1,90 0,002 0,004 0,39 0,0001 0,0004 0,024 0,0004 0,0027 |
|
ИТОГО: |
100 |
79,8 |
Тепловые потоки:
Технического этилена
![]() [6]
[6]
где GM – материальный поток, кмоль/с
t – температура, 0С
![]() – средняя молярная теплоемкость, Дж/(моль·К)
– средняя молярная теплоемкость, Дж/(моль·К)
Технического этилена:
Q1=0,04·43,56·25 = 43,56 кВт
Технического хлора:
Q2=0,04·33,88·25 = 33,88 кВт
Продукты реакции +остальные:
Q3=(0,043+0,002)·79,8·55 = 197,5 кВт
Рассчитаем теплоты реакции.
Теплоты образования веществ (кДж/моль)
С2Н4 52,28 [5]
Cl2 0
HCl -92,31
C2H4Cl2 -130,02
C2H3Cl3 -138,49
C2H3Cl 31,37
C2H5Cl -105,0
![]() [5]
[5]
где ![]() - теплота химической реакции
- теплота химической реакции
![]() - теплота продуктов реакции
- теплота продуктов реакции
![]() - теплота исходных веществ
- теплота исходных веществ
1. С2Н4+Сl2→C2H4Cl2
![]() = -130,02 – (0+52,28) = -182,3 кДж/моль
= -130,02 – (0+52,28) = -182,3 кДж/моль
2. С2Н4+2Сl2→C2H3Cl3+НCl
![]() = -138,49+(-92,31) – 52,28 = -283,08 кДж/моль
= -138,49+(-92,31) – 52,28 = -283,08 кДж/моль
3. С2Н4+Сl2→C2H3Cl+НCl
![]() = 31,37+(-92,31) – 52,28= -113,22 кДж/моль
= 31,37+(-92,31) – 52,28= -113,22 кДж/моль
4. С2Н4+НСl→C2H5Cl
