Химия цвета
Перемену цвета, вызванную изменением состояния электронов и связанную с перестройкой структуры, можно объяснить колебательным движением в кристалле. Допустим, что частицы в кристалле закреплены неподвижно. В таком случае каждая из них испытывала бы строго симметричное влияние (рис. 8, а). Появляющаяся деформация от разных соседей компенсировала бы друг друга, В действительности же в кристалле
непрерывно совершаются колебательные движения. Расстояния между частицами при таких колебаниях меняются, вызывая соответственно изменение распределения зарядов — поляризацию (рис. 8, б). Если поляризующее действие соседей и собственная деформируемость ионов или атомов достаточны, то это скажется на состоянии электронов, которые будут уже воспринимать кванты видимого света.
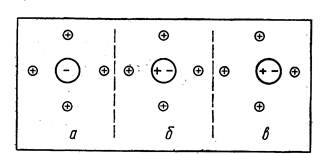
Рис. 8. Влияние поляризации на положение атомов в кристаллической решетке.
Если колебательные движения велики или усиливаются, например нагреванием, то возникающая деформация увеличивает притяжение ионов и закономерный характер колебательного движения нарушается (рис. 8, в). Происходит дальнейшее сближение, а это вызывает перестройку кристаллической структуры вещества. В результате такой перестройки может оказаться, что ион окружен соседями, расположенными уже на более близком расстоянии. А иногда меняется и их число; одни из соседей стали ближе (три из четырех катионов на рис. 8, в), а другие дальше, чем были прежде.
Примерами образования таких соединений, имеющих разный цвет, являются желтая и оранжевая формы оксида свинца РЬО. Первой из нихсоответствует ромбическая конфигурация, а второй — тетрагональная.
Влияние структуры ни цвет проявляется и в более сложных соединениях. Так, хромат свинца РbСrO4 может быть и темно-желтым (моноклиническая кристаллическая решетка), и светло-желтым (ромбическая структура). Следовательно, приводящее к перемене окраски изменение пространственного расположения может происходить и с большой группой атомов. В хромате свинца это касается молекулы из шести атомов.
Молекулы бесцветны, а вещество окрашено
И все же в некоторых случаях цвет одного и того же вещества зависит вовсе не от структуры. Точнее, не от типа кристаллической решетки. Нет в природе таких веществ, чтобы их структура была совершенна. Человек пытается исправить эту природную «недоработку» и выращивает кристаллы, близкие к идеальным. Без таких кристаллов немыслима современная оптика. Однако природные кристаллы поражают разнообразием цвета и его оттенков. В этом можно убедиться, если посмотреть на кристаллы даже таких простых веществ, как встречающиеся в земле поваренная соль или карбонаты.
В окрестностях польского городка Велички есть соляные разработки, где обширные коридоры и огромнейшие валы, вырубленные в Пластах каменной соли, тянутся галереей на десятки километров. В нишах по бокам галереи можно видеть фигуры, сделанные из соли, и удивительной формы кристаллы. Слабо освещенные, они производят фантастическое впечатление. Иногда они окрашены в синий или фиолетовый цвет. Откуда берется эта окраска в гигантской массе бесцветной соли? Цвет кристаллов, построенных из бесцветных ионов и атомов, появляется в результате нарушений идеальности кристаллической решетки. Несовершенства бывают нескольких видов.
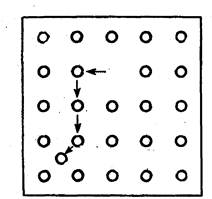
Рис. 9. Дефекты кристаллической структуры: образованно вакансии и появление атома между узлами кристаллической решетки.
Во-первых, из-за неправильного расположения атомов, составляющих кристаллическую решетку (рис. 9). Атомы отсутствуют там, где они должны быть — в узлах кристаллической решетки; возникают незанятые места — вакансии. Смещенные атомы могут появиться в промежутках между теми, которые сохраняют свое нормальное положение. В кристаллические несовершенства включаются и крупные нарушения порядка. Большинство кристаллических тел имеет мозаичное или блочное строение. Между такими блоками (зернами) правильное расположение во многих случаях нарушено. Размеры блоков чаще всего бывают от 1000 до 10000 атомных диаметров, а на их границах образуется область с неправильным расположением атомов. Такие несовершенства обусловливают наличие в кристалле центров окраски из-за того, что в этих местах нарушается нормальное взаимодействие электромагнитного поля, создаваемого ионами и электронами с электромагнитным падающим потоком квантов. Подобный тип окрашенных соединений широко распространен в природе.
Во-вторых, окраску бесцветных веществ определяет наличие атомов посторонних элементов и случайных примесей. Инородные атомы могут быть рассеяны по всему кристаллу или группироваться вместе. И в этом и в другом случае они искажают кристаллическую решетку. Синий или фиолетовый цвет бесцветной каменной соли возникает из за выделения под влиянием радиоактивного излучения металлического натрия. Иногда наряду с хлоридом натрия в ней содержатся и частицы других солей, которые нарушают структуру так же, как металлический натрий.
Совсем недавно для всеобщего обозрения открыта Новоафонская пещера, поражающая своими размерами. В залах, высота которых достигает 100 м, с потолка свешиваются огромные сталактиты. Навстречу им со дна пещеры в виде столбиков поднимаются сталагмиты. Порой и те и другие соединяются вместе, образуя причудливой формы колонны. Убранство залов, подобно убранству подземных дворцов Хозяйки Медной горы из сказки П. П. Бажова, сверкает разноцветием. Откуда же берется эта фантазия красок? Ведь основной составляющий компонент сталактитов и сталагмитов — кальцит, который является одной из двух кристаллических бесцветных форм карбоната кальция СаСОз. Цвет кристаллов вызван включениями посторонних молекул и ионов, часть из которых имеет собственную окраску. Ионы и атомы натрия и калия придают подземным украшениям голубой, синий или фиолетовый оттенок; рубидий и цезий красный или оранжевый. Различные сочетания этих элементов образуют всю красочную полигамию кристаллов, образующих сталактиты, сталагмиты, сталагматы.
Цвет полярных молекул
Когда катионы попадают в поле действия анионов, то возникает взаимное влияние (рис. 10). Результаты зависят от способности электронных оболочек ионов к деформации. Эта способность обусловлена природой иона и силой, с которой данный ион может воздействовать на оболочки соседей. Как правило, ионы малого радиуса и большого положительного заряда деформируются слабо: очень крепко в таком случае положительное ядро притягивает электроны. Деформируемость и связанная с ней поляризация невелика и в том случае, если внешняя электронная оболочка иона подобна оболочке инертного газа, т. е. завершено ее заполнение электронами.
Если молекула состоит из ионов с заполненными электронными оболочками (MgO, ZnS), то возможность перехода электрона практически исключена, так как ему, попросту говоря, некуда переходить. Тогда из всего спектра видимого света молекула не отдает предпочтения ни одному участку. Такие молекулы не имеют окраски. В растворе они бесцветны, а в твердом состоянии белые. К такому типу красящих веществ относятся оксид цинка, оксид магния, фосфат и сульфид цинка, сульфат бария. Как видите, это все соединения элементов II группы периодической системы с полностью завершенными внутренними электронными оболочками.
Другие рефераты на тему «Химия»:
- Получение хлора и щелочи путем электролиза водных растворов хлоридов щелочных металлов. Извлечение ртути
- Специфичность фермента амилазы
- Качественный анализ (кислотно-основная классификация)
- Алхимия как культурный феномен арабского и европейского средневековья
- Влияние температуры на доменное структурообразование в сегментированных уретановых полимерах
