Специфичность фермента амилазы
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
1.2. АМИЛАЗЫ СТРОЕНИЕ, ФУНКЦИИ
1.3 СПЕЦИФИЧНОСТЬ АМИЛАЗЫ
1.4. ВЛИЯНИЕ ИНГИБИТОРОВ И АКТИВАТОРОВ НА АКТИВНОСТЬ АМИЛАЗЫ
2. ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
3. ЗАКЛЮЧЕНИЕ 4. СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ ВВЕДЕНИЕ Одним из фундаментальных понятий, как биологии, так и химии является понятие «фермент».Изуч
ение ферментов имеет большое значение для любой области химической, пищевой и фармацевтической промышленности, занятых производством биологически активных веществ для медицины и народного хозяйства. Поэтому одним из ключевых понятий общей биохимии является понятие «фермент».
Актуальность работы: амилазы широко используются в пищевой промышленности. Так амилазы используются в хлебопечении и технологиях брожения. Также амилаза играет значительную роль в расщеплении крахмала в организме человека. Поэтому понимание действия амилазы важно для оптимизации промышленного производства и изучения обмена веществ в организме человека.
Цель: данной работы рассмотреть специфичность действия амилазы. В рамках достижения поставленной цели необходимо рассмотреть следующие задачи:1. Изучить классификацию ферментов.2. Разобрать строение и функции фермента амилаза.3. Изучить специфические действия фермента амилаза.4.Рассмотреть влияние ингибиторов и активаторов на активность амилазы. 1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Современная классификация ферментов разработана в 1961 г. Комиссией по ферментам Международного биохимического союза. В основу классификации положен тип катализируемой реакции, которая является специфичным для каждого фермента.
Согласно этой классификации все ферменты делят на 6 главных классов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции;
2. Трансферазы – катализируют реакции межмолекулярного переноса групп атомов и радикалов;
3. Гидролазы – катализируют реакции расщепления при участии воды;
4. Лиазы – катализируют реакции внутримолекулярного негидролитического расщепления, с образованием двойной связи или присоединения по двойной связи;
5. Изомеразы – катализируют реакции изомеризации;
6. Лигазы (синтетазы) – катализируют реакции синтеза с затратой энергии.
Оксидоредуктазы.
К классу оксидоредуктаз относят ферменты, катализирующие реакции окисления-восстановления. Общая схема может быть представлена следующим образом:
![]()
Окисление протекает как процесс отнятия атомов Н (электроном от субстрата, а восстановление – как присоединение атомов Н (электронов) к акцептору. Если обозначить рецептор буквой А, а субстрат В, то уравнение реакции окисления–восстановления при участии оксидоредуктаз примет такой вид:
![]()
В природных объектах обнаружено около 500 индивидуальных оксидоредуктаз. Наиболее распространены оксидоредуктазы, содержащие в качестве активной группы никотинамидадениндинуклеотид, или НАДН+. Их принято называть дегидрогеназами.
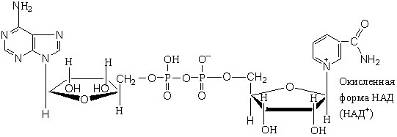
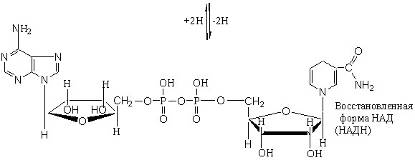
Число известных процессов окисления спиртовых групп до карбонильных с помощью никотинамидных коферментов превышает две сотни. Например, важный промежуточный этап окисления глюкозы – это окисление глицеральдегид-3-фосфата, который протекает по реакции и приводит к образованию смешанного ангидрида 3-фосфоглицериновой кислоты и ортофосфорной кислоты – 1,3-дифосфоглицерата.
![]()
Такой характер окисления имеет важное биоэнергетическое значение, поскольку остаток фосфорной кислоты, образующий ангидридную связь, может быть перенесен от 1,3-дифосфоглицерата на АДФ с образованием АТФ. Фермент, катализирующий эту реакцию, называют глицеральдегид-3- фосфатдегидрогеназой.
Особого рассмотрения заслуживает подподкласс оксидоредуктаз, к которым относится небольшое число исключительно важных ферментов, катализирующих окислительное декарбоксилирование кетокислот остатком липоамида, связанного амидной связью с через аминогруппу остатка лизина с апоферментом трансацетилазой:
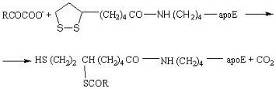
Кофактором этих ферментов является тиаминпирофосфат:
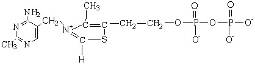
Схема превращений, происходящих в активном центре фермента участием реакционноспособного карбаниона тиаминпирофосфата можно представить в виде
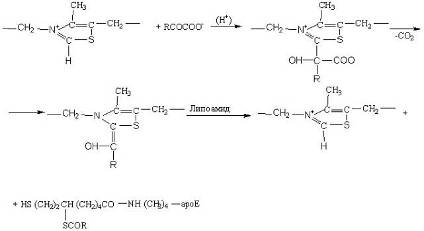
Образовавшийся дигидролипоамид окисляется с помощью НАД+ третьим ферментом, участвующим в окислительном декарбокиировании, – дигидролипоамид дегидрогеназой, катализирующей реакцию
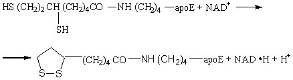
Ферменты, катализирующие превращения с участием молекулярного кислорода, разделаются на три основные группы: оксидазы, монооксигеназы и диоксигеназы. К оксидазам относятся ферменты, катализирующие процессы, в результате которых О2 восстанавливается до Н2О2 или до двух молекул воды. Примером подоюных ферментов могут служить глюкозооксидаза и цитохром с оксидаза, катализирующая окисление ферроцитохрома с до феррицитохрома по реакции:
Цитохром с Fe (II) + 4H+ + O2 > 4 Цитохром с Fe (III) + 2H2O
К моноксигеназам относят ферменты, катализирующие окисление органических соединений, приводящее к включению одного из атомов кислорода молекулы О2 в молекулы этих соединений, и восстановление второго атома кислорода до воды. Суммарное уравнение реакции можно записать в виде
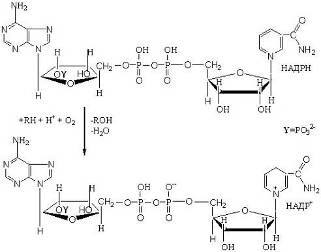
К монооксигеназам относится важная группа ферментов, известных под общим названием цитохромы Р450.
Диоксигеназы катализируют превращения, в ходе которых оба атома молекулы кислорода О2 включаются в состав окисляемого субстрата. Например, деструкция триптофана начинается с реакции образования формилкенуренина, в состав которого входят оба атома кислорода молекулы О2. Фермент, катализирующий эту реакцию, является гемопротеидом и называется триптофан 2,3-диоксигеназой.
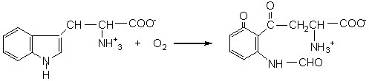
Фермент, катализирующий диспропорционирование свободного радикала НO2, образующегося в некоторых реакциях с участием О2 и являющегося очень сильным окислителем, называют супероксидисмутазой. Он катализирует реакцию
HO2 + HO2 > H2O2 +O2
Фермент является металлопротеидом и в зависимости от источника содержит Cu2+, Zn2+, Mn2+, или Fe2+.
Трансферазы.
В этот класс входят ферменты, ускоряющие реакции переноса функциональных групп и молекулярных остатков от одного соединения к другому. В зависимости от характера переносимых группировок различают фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, трансферазы, переносящие одноуглеродные остатки (метилтрансферазы, формилтрансферазы), и др.
