Химия цвета
Замена молекул воды на аммиак углубляет цвет. Аммиачные молекулы деформируются легче и интенсивность окраски усиливается. При этом следует учесть, что происходит более тесное взаимодействие катиона Сu2+ с аммиаком — образуется комплексный ион [Cu(NH3)4] +. На усилении интенсивности цвета Сu2+ основана и известная реакция на многоатомные спирты. Голубой осадок Сu(ОН)2 переходит в интенсивный си
ний при образовании глицерата меди. Органическая молекула легко деформируется под действием иона меди. В случае меди деформация, видимо, влияет на устойчивость одного из d-электронов меди. Он становится способным, поглощая уже длинноволновые кванты, пороходить в возбужденное состояние. Если легко деформируемый анион вытесняется из окружения катиона менее поляризуемым, то окраска может исчезнуть вовсе. Например, РbI2 в твердом виде золотисто-желтый, а в растворе бесцветен. При растворении и последующей диссоциации ион I-, окружавший свинец в твердом соединении, заменяется труднее деформируемыми молекулами воды. А раз нет деформации, то исчезает и цвет.
Еще более резко, чем просто растворение, может сказываться на цвете соединения замена одного растворителя другим. Синий раствор CoCl2 в этиловом спирте при разбавлении его водой становится розовым. Вместо привычного голубого цвета гидратированных ионов меди появляется золеный, если белый порошок безводной соли СuСl2 растворить но в воде, а в этиловом спирте.
Причиной изменения окраски является различная деформируемость молекул растворителей и катионов, испытывающих в свою очередь поляризующее действие со стороны молекул воды или этанола. Подвижные легко возбуждающиеся электроны становятся способными поглощать иные кванты видимого цвета. Ион кобальта в воде менее поляризован и для его «цветных» электронов требуются более короткие лучи. Он пропускает или отражает длинноволновые, отчего его водный раствор кажется розовым. В спиртовом растворе меди в отраженных лучах уменьшается доля синих лучей, и спиртовой раствор становится зеленым. При замене растворителя окраска даже может вовсе исчезнуть. Цветной ион становится как бы невидимкой: в воде бесследно исчезает золотисто-желтая окраска РbI2. Исчезновение объясняется тем, что вещество распадается на отдельные ионы, каждый из которых бесцветен, будучи вместе в осадке, они обусловливают цвет. Точно так же происходит с димерными молекулами Аl2Cl6, которые имеют синий цвет в этаноле и лишаются окраски в воде, потому что при диссоциации вода разобщает катионы А13+ и анионы С1-.
Иногда исчезновение цвета происходит и без распада вещества на ионы.
Ярко-красная соль иодида ртути HgI2 становится совершенно бесцветной при растворении в эфире. Специальными исследованиями установлено, что молекулы находятся в растворе в недиссоциированном виде. Причиной исчезновения окраски, как полагают, является уменьшение деформации ионов. В эфире образуются сольватные комплексы типа [HgI2 (эфир) x]. Число частиц, на которых оказывает свое поляризующее действие катион Hg2+, возрастает: ведь наряду с двумя легко деформируемыми ионами I1- появляется несколько молекул эфира. Силовое поле катиона дробится между частицами. Его действия уже не хватает, чтобы вызвать поляризацию всех частиц сразу. Деформация каждой из них мала, а у анионов I1- становится существенно меньше, чем в твердом состоянии. Следствием такого изменения взаимодействия становится исчезновение цвета. Нужно всего лишь наполовину уменьшить действие двухзарядного катиона ртути на анион иода, чтобы уменьшилась их деформация до такой степени, что молекула становится неокрашена, даже если при этом возрастают ее размеры. Именно так обстоит дело, когда к ярко окрашенному осадку РbI2 или HgI2 приливают избыток раствора иодида калия. Образующиеся ионы [РbI4]2-и [HgI4]2- окраски в видимом свете не имеют.
Известно, что кристаллический иод практически нерастворим в воде. В 100-процентной H2SO4 образуется розовый раствор, а в 30-процентвом олеуме 0,5 М раствор иода имеет коричневый цвет, такой же, как и в этиловом спирте. Растворители меняют состояние молекул и ионов. В среде концентрированной серной кислоты существуют комплексы и ионы; розовый — I3+, синий I+, коричневый I5+.
Основы структурной теории цветности органических молекул
Попытки связать цвет органического вещества с его структурой предпринимаются исключительно давно. Примерно сто лет назад была выдвинута порвал теория, соединившая окраску с наличием в молекуле соединений определенных групп атомов.
Особое значение для структуры окрашенного соединения имеет цепочка атомов С, связанных друг с другом чередующимися двойными и одинарными связями:
-СН=СН-СН=СН- и т. д.
В таких цепочках проявляется эффект сопряжения. Происходит как бы выравнивание двойных и одинарных связей:
![]()
Перекрывание орбиталей, на которых находятся π-электроны, таково, что появляется возможность образования как бы дополнительной связи и между теми углеродными атомами, которые соединены одинарной связью; все атомы охватываются едиными молекулярными орбиталями. Электрон получает возможность передвигаться по всей молекуле в целом.
С подобным эффектом сопряжения мы встречаемся при изучении свойств бензола, у которого невозможно различить отдельные двойные и одинарные связи; да их в молекуле СбНб и нет — все связи равноценные (рис. 12).
Однако образование таких делокализованных л-связей накладывает ограничение на строение молекулы: чтобы электронные орбитали могли перекрываться, атомы в молекуле должны лежать хотя бы примерно в одной плоскости.
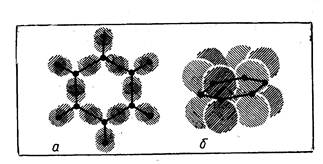
Рис. 12. Электронное строение молекулы бензола: а — σ-связи; б — π--связи.
Опытным путем еще до того, как были открыты закономерности электронного строения и его изменение при взаимодействии молекулы вещества с лучом света, удалось подметить наиболее важное по влиянии структурных фрагментов молоекул па цвет соединений. Так оказалось, что удлинение цепи сопряженных двойных связей приводит к переходу от бесцветного или слабоокрашенного к темным цветам:
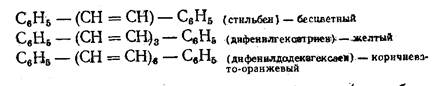
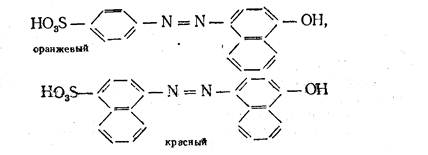
Если вместо простых ароматических ядер (типа бензольных) появляются конденсированные (типа нафталина), то это вызывает углубление цвета,
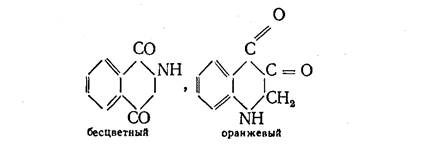
Группы С = О, связанные друг с другом, вызывают более глубокий цвет соединения:
Более прочная и более тесная связь между атомами углерода, относящимися к отдельным частям молекулы, приводит к более интенсивной и более глубокой окраске:
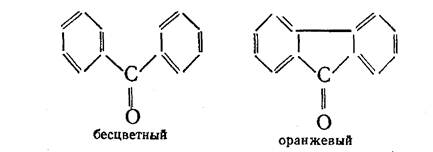
Кроме цепей сопряжения, ответственными за цвет являются и другие группы атомов, между которыми тоже имеются ненасыщенные связи. Такие группы, благодаря которым возникает возможность появления цвета у вещества, получили название хромофоры от греческих слов «хрома» — цвет и «форео» — несу, иначе говоря — «несущие цвет». Вот примеры нескольких таких групп:
Другие рефераты на тему «Химия»:
- Краткая классификация специальных методов ректификационного разделения
- Совершенствование технологии изготовления вкладыш-пустотообразователя на основе полипропилена
- Коррозия и защита металлов
- Индикаторы требования к ним и классификация
- Способы получения стирола. Совмещенное дегидрирование и окисление метанола
