Химия цвета
Далеко не все органические вещества обладают цветом. Однако у тех веществ, которые имеют окраску, в структуре молекул есть принципиальное сходство. Все они, как правило, большие молекулы, состоящие из десятков атомов. Для возникновения цвета имеют значение не электроны отдельных атомов, а состояние системы электронов, охватывающей всю молекулу целиком. Подвижность такой системы, ее способность
легко изменять свое состояние под небольшим воздействием световых квантов и обусловливает избирательное поглощение определенных волн из набора, составляющего видимый свет.
Чтобы понять зависимость цветности от строения, нужно рассмотреть, в чем состоят особенности энергетического состояния электронов того или иного типа молекул.
Спектры поглощения и цвет неорганических веществ
Тот или иной цвет вещества означает, что из всего интервала 400-700 нм длин волн пилимого света им поглощаются какие-то определенные кванты, энергия которых в общем-то невелика.
Из этого в свою очередь следует, что в молекулах окрашенных веществ энергетические уровни электронов довольно близко расположены друг к другу. Если разница ΔЕ велика, то употребляются другие кванты, несущие больше энергии, например, ультрафиолетовые. Такие вещества, как азот, водород, фтор, благородные газы, кажутся нам бесцветными. Кванты видимого света не поглощаются ими, так как не могут привести электроны на более высокий возбужденный уровень. Если бы наши глаза способны были воспринимать ультрафиолетовые лучи, то в таком ультрафиолетовом свете и водород, и азот, и инертные газы казались бы ним окрашенными.
Чем больше электронов в атоме, тем теснее друг к другу электронные уровни. Особенно хорошо, если в атоме есть незанятые электронами орбиты. В таком случае для перехода электрона из одного состояния в другое требуются кванты света уже с меньшей энергией, которую несут лучи видимой части спектра. Такие многоэлектронные галогены, как хлор, бром, иод, уже окрашены. Имеют окраску оксиды азота NО2, N2О3 и ковалентные соединения, например CuCl2, AlI3. Окраска молекул (рис. 1.), состоящих из нескольких атомов, зависит от целого ряда факторов. Если действие этих факторов таково, что они сближают электронные уровни, то это способствует появлению или углублению окраски. Так более тесное взаимодействие атомов при переходе из газообразного в жидкое и далее твердое состояние может способствовать появлению или
углублению цвета, особенно в тех случаях, когда у атомов есть незанятые электронами орбиты.
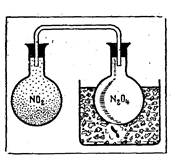
Рис. 1. Окраска оксида азота (IV) исчезает при охлаждении (образуется димер N2O4) и вновь появляется при нагревании.
Различие в характере взаимодействия сказывается на спектрах. Спектры поглощения простейших молекулярных соединений — газов и веществ в газообразном состоянии — состоят из нескольких серий узких полос (линий). Это значит, что из всего потока белого света они выбирают лишь некоторые фотоны, энергия которых как раз равна разнице между основным и "возбужденным" состояниями электронов. В жидком и особенно твердом состоянии спектр становится по существу сплошным, так как из-за сильного взаимодействия близко расположенных атомов появляется много новых энергетических уровней электронов и, следовательно, увеличиваются возможности новых электронных переходов, растет число уровней энергии молекул и ионов. В спектр входит большое число широких полос, простирающихся на несколько десятков нанометров. Интенсивность полос и их различное наложение друг на друга определяет итоговый цвет вещества. Ведь при различных сочетаниях основных цветов: красного, синего, зеленого или красного, желтого, синего получаются все другие цвета спектра.
Как правило, полосы поглощения у неорганических веществ начинаются в видимой области, а заканчиваются в ультрафиолетовой. Положение наиболее интенсивных полос поглощения и определяет цвет (табл. 1.).
Таблица 1.

Цвет вещества складывается из суммы отраженных волн (или прошедших вещество без задержки), причем интенсивность тех или иных волн может быть различна. Поэтому даже если спектр состоит из одних и тех же волн, но их относительная доля в спектре изменена, то мы видим вещества разного цвета. Лучи, комбинируясь в спектре друг с другом, дадут разную окраску. Вот пример. Кадмий и ртуть — элементы одной и той же подгруппы II группы периодичоской системы. Их атомы отличаются друг от друга числом внутренних электронов. Их сульфиды HgS и CdS сильно поглощают лучи фиолетовой части спектра и значительно слабее — красно-оранжевой (рис. 2.). В результате, казалось бы, незначительной разницы в отражении получается уже иная комбинация: сульфид кадмия оказывается желтым, а сульфид ртути — оранжевым.
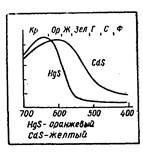
Рис.2. Разница в спектрах поглощения определяет цвет.
На диаграмме приведены спектры нескольких веществ, у которых различна интенсивность отражения волн разных участков видимого света. На рисунке 3 указано, при каких соотношениях мы видим тот или иной цвет. В том случае, если кривые пересекаются, цвета взаимно "уничтожают" друг друга и мы видим только тот цвет, который остается. При отражении цвета с длиной волны 480 нм вещество синее, так как взаимно уничтожились красный и зеленый цвета. При 500 нм — зеленое, выше 600 нм — красное с желтоватым оттенком. Цветовое ощущение от разных окрасок (получаемое, например, при наложении цветных стекол) воспринимается нами как суммарное.
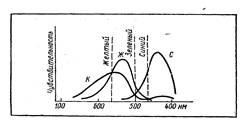
Рис. 3. Видимый цвет есть результат наложения основных цветов, соответствующих трем нервным центрам, создающих ощущение красного, зеленого и синего.
Особенности твердого состояния неорганических красителей
В первую очередь следует помнить, что неорганические красители, как природные, так и синтетические,— кристаллические тела. Особенностью их является упорядоченное расположение многих сотен и тысяч атомов, ионов или молекул. Различаются они как по типу входящих в твердое тело частиц, так и по типу химических связей между ними.
Для того чтобы понять их структуру, рассмотрим на знакомых из школьного курса химии примерах особенности того или иного вида построения агрегатных состояний.
В газообразном состоянии вещества характеризуются значительными расстояниями между частицами и малыми силами взаимодействия между ними. Они способны занимать любой предоставленный объем, и их свойства в основном определяются поведением отдельных частиц. В жидком же состоянии частицы веществ сближены на расстояния, соизмеримые с их размерами, силы взаимодействия между частицами значительны. Частицы вещества объединяются в крупные агрегаты, в которых их взаимное расположение упорядоченное и движение носит колебательный характер (ближний порядок). На значительных расстояниях от центров агрегатов (дальний порядок) эта упорядоченность нарушается. Прочность связей между агрегатами частиц в жидкости невелика, поэтому в жидком состоянии вещество занимает определенный объем, но способно изменять форму под действием силы тяжести. Поведение веществ в этом состоянии определяется как свойствами частиц и их агрегатов, так и взаимодействиями между ними.
