Цезий
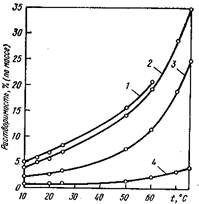
Рис. 1 Растворимость алюмоквасцов аммония (1), калия(2), рубидия(3) и цезия (4) в воде
Алюмоквасцы – это один из первых промежуточных продуктов производства рубидий и цезия из лепидолитов, которые представляют собой изоморфную смесь калиевых, рубидиевых и це-зиевых квасиов. Последующее разделение этих квасцов основано н
а различной их растворимости и осуществляется многократной фракционной кристаллизацией.
При нагревании алюмоцезиевые квасцы сначала плавятся (при 109 и 122° С соответственно), а затем постепенно теряют гидратную воду. Полное обезвоживание для СsА1 (S04)·12Н20 температуры равны соответственно 235 и 780° С.
Железоцезиевые квасцы имеют достаточно высокий температурный коэффициент растворимости и резко отличаются по растворимости и устойчивости от квасцов щелочных металлов. Этим можно воспользоваться для эффективного отделения цезия от других щелочных металлов.
Для получения квасцов железный купорос сначала окисляют в водном растворе азотной кислотой, а затем смешивают с сернокислым раствором сульфата цезия и упаривают до начала кристаллизации.
Среди марганцевых квасцов наиболее устойчивыми являются цезиево-марганцевые СзМн (304)г-12Н20. В воде эти квасны гидролизуются с выделением гидратированной трехокиси марганца, плавятся они при 40° С.
Нитраты цезия(МеNОз) представляют собой бесцветные гигроскопичные иглы и призмы. У нитрата цезия известны четыре две модификации.
Термическое разложение нитратов цезияс выделением кислорода происходит по реакции: 2МеNОз = 2МеNО2 + О2, при 490° С для цезия.
Как видно на рис. 2 растворимость нитратов в воде с повышением температуры возрастает, но в органических растворителях они нерастворимы.
Нитраты цезия легко получают взаимодействием азотной кислоты с их карбонатами, хлоридами или гидроокисями. Растворимость нитратов в азотной кислоте возрастает в ряду щелочных металлов и не подчиняется правилу периодичности свойств:
NaNОз< RbNОз<СsNОз< КNОз
Карбонаты цезия представляют собой белые очень гигроскопичные непрозрачные ромбические кристаллы, расплывающиеся на воздухе и переходящие вследствие поглощения С02 в соответствующие гидрокарбонаты МеНСО3·К2С03 с выделением тепла, для Сs2С03 11,87 ккал / моль. В атмосфере двуокиси углерода он плавится без заметного разложения при 873° С, но при нагревании их выше температур плавления (особенно в вакууме) наблюдается диссоциация с отщеплением СО2.
В отличие от карбоната лития карбонаты цезия легко раство ряются в воде (при 25° С растворимость карбонатов калия, цезия на 100 г. воды соответственно следующая, г: 111,8; 223,0 н 308,3). Карбонат цезия (в отличие от карбонатов рубидия и калия) растворим в абсолютном спирте до 10% при 20° С. На этом свойстве карбоната цезия основана очистка цезия рубидия и калия.
Карбонаты цезия образуют целый ряд кристаллогидратов, точный состав которых до сих пор окончательно не установлен. Для карбоната цезия известны кристаллогидраты: Сs2С03·8Н2O и Сs2С08·5Н2О при низких температурах и 2Сs2С03·7Н20 – стабильный при обычной температуре. Полная дегидратация Сs5С03 проходит при 150° С.
Основной метод получения карбонатов цезия – прокаливание:их тетраоксалатов или кислых тартратов]
Гидрокарбонаты (бикарбонаты) цезияMеНСО3 выделяются в виде безводных призм или игл ромбической сингонии из 13–20%-ных растворов карбонатов при пропускании двуокиси углерода. При нагревании выше 170–180˚ С. гидрокарбонаты разлагаются с выделением двуокиси углерода.
Комплексные соединения цезия. Гетерополисоединения цезия представляют собой соли с комплексными анионами сложного строения.
Крeмнемолибдаты цезия Ме3Н6 [Si(Мо2О7)6]·Н20 сравнительно мало растворимы в воде, серной, азотной и щавелевой кислотах. Растворимость почти не зависит от температуры и при 25° С составляет 0,48г на 100 г. воды. В соляной кислоте растворимость еще меньше.
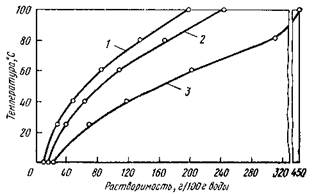
Рис. 2. Растворимость нитратов цезия (1), калия(2) и рубидия
Кремневольфраматы цезия состава (Сs)8Si(W8O7)8·nН2О Плохо растворимы в воде, нерастворимы в спирте и разбавленной соляной кислоте. Обычным методом получения кремнсвольфраматов является взаимодействие кремневольфрамовой кислоты и хлоридов цезия.
Фосфоромолибдаты цезия состава Ме3H4 [Р(Мо3O7)6)]·nН2О выпадают при взаимодействии фосформолибденовой кислоты и 1%-ных водного раствора CsCl. Растворимость фосфоромолибдатов К RЬ и Сs при 20° С равна 3,8·10-9, 6,2–10-4; 5,6–10-4 г в 100 г. воды соответственно; в 0,1н. азотной кислоте растворимость этих солей К, КЬ и Сs составляет соответственно 8,02; 1,7–10-9 и 9,4–10-4 г в 100 г. растворителя. Эннеахлордиарсенаты цезия Ме9[As2С19] мало растворимы в концентрированной соляной кислоте, растворимость их при 20° С в 100 г. воды 36%-ной НС1 составляет 2,935 и 0,429 г. соответственно. Аналогичной соли калия не обнаружено.
Эннеахлордистнблаты цезияМе3 [SЬ2С19] – довольно устойчивые на воздухе соединения, разлагающиеся с выделением SbС18 только при нагревании до 450° С в вакууме. В воде Cs3 [Sb2 С19] подвергаются сильному гидролизу.
Селенид Сs2 Sе и теллурид Cs2Te синтезируют сплавлением цезий соответственно с Sе и Те в вакууме. CsN2 в обычных условиях цезий не взаимодействует, с жидким N2 при электрическом разряде между электродами, изготовленными из цезия, образует нитрид Cs3N. Цезий растворяется в жидком NH3, алкиламинах и полиэфирах, образуя синие растворы, обладающие электронной проводимостью; в аммиачном растворе цезий медленно реагирует с NH3 с выделением Н2 и образованием амида СsNH2. С газообразным NH3 при 120 °С образует Cs NH2, с красным Р в вакууме при 400–430 °С – фосфид Cs2P, с порошком графита при 200–500 °С – карбид С8Cs, а при более высоких температурах – С24Cs, Cs36Cs и др. карбиды, с ацетиленом при 300 °С в вакууме – ацетиленид Cs2C2, с Si и Gе в атмосфере Аr при 600 °С – соответственно силицид CsSi и германид CsСе. Цезий, взаимодействуя с С02, ССl4 со взрывом. Выше 300 ˚С разрушает стекло, восстанавливая Si из SiO2 и силикатов. Цезий реагирует со всеми компонентами с образованием соответствующих солей, со спиртами дает алкоголяты.
Цезий образует твердые растворы с К и КЬ, эвтектическая смесь с Nа, не смешивается с Li, Со многими металлами дает интерметаллады, например CsАu, CsSn4.
Распространенность цезия в природе и его производство
В литературе нет точных данных о том, сколько цезия имеется на земном шаре. Известно лишь, что он относится к числу редких химических элементов. Полагают, что его содержание в земной коре во всяком случае в несколько сот раз меньше, чем рубидия, и не превышает 7·10–4%.
Цезий встречается в крайне рассеянном состоянии (порядка тысячных долей процента) во многих горных породах; ничтожные количества этого металла были обнаружены и в морской воде. В большей концентрации (до нескольких десятых процента) он содержится в некоторых калиевых и литиевых минералах, главным образом в лепидолите. Но особенно существенно то, что, в отличие от рубидия и большинства других редких элементов, цезий образует собственные минералы – поллуцит, авогадрит и родицит. Родицит крайне редок, притом некоторые авторы причисляют его к литиевым минералам, так как в его состав (R2O · 2Al2O3 · 3B2O3, где R2O – сумма окисей щелочных металлов) входит обычно больше лития, чем цезия. Авогадрит (K, Cs) [BF4] тоже редок, да и поллуциты встречаются нечасто; их залежи маломощны, зато цезия они содержат не менее 20, а иногда и до 35%. Наибольшее практическое значение имеют поллуциты США (Южная Дакота и Мэн), Юго-Западной Африки, Швеции и Советского Союза (Казахстан и др.).
