Кислотно-каталитические процессы в нефтепереработке и в нефтехимии. Решение обратной задачи кинетики статистическими методами
В рамках рациональной стратегии структура кинетической модели задается (для каждой гипотезы) и решение обратной задачи проводится для оставшихся не отклоненных моделей. Задача сводится к оцениванию констант (параметров модели) и к сравнению качества описания эксперимента различными моделями.
Более простой случай – оценивание констант для линейных моделей (в дифференциальной или интегральн
ой форме), например,
![]()
![]()
Оба уравнения – линейные функции y = bx и константа b находится методом наименьших квадратов (МНК).
В случае нелинейных моделей типа уравнений (15) или (20) решается менее строгая задача нелинейного оценивания. Параметры модели перебираются так, чтобы обеспечить минимум функционала
![]() . (24)
. (24)
При этом решение является не единственным, т.е. возможно существование множества наборов констант (параметров) уравнения, одинаково хорошо описывающих эксперимент. Адекватность модели оценивается по критериям Фишера, а значимость параметров – по критерию Стьюдента.
При решении обратной задачи следует иметь ввиду и закоррелированность параметров, также не позволяющую получить единственный набор констант (кроме причин, связанных с особенностями поверхности функционала (24)). Существует проблема идентифицируемости параметров.
Пример. Рассмотрим простейшую схему каталитической реакции (схема Михаэлиса-Ментен)
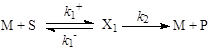 (25)
(25)
В квазистационарных условиях
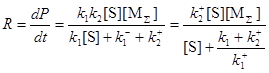 (26)
(26)
В этом простом случае очевидно, что определяемыми (идентифицируемыми) параметрами будут ![]() и
и ![]() . Этот случай неидентифицируемости называется локальной неидентифицируемостью.
. Этот случай неидентифицируемости называется локальной неидентифицируемостью.
Пример. Рассмотрим случай глобальной неидентифицируемости. При анализе нестационарной последовательной реакции
![]()
показано, что можно определить все три константы, но решение не является единственным. Рассчитанные значения [А]t и [B]t не изменяются, если ![]() и
и ![]() поменять местами.
поменять местами.
Таким образом, априорный анализ кинетической модели для выяснения параметров, которые могут быть оценены, является важным этапом процедуры решения обратной задачи химической кинетики.
Кислотно-каталитические процессы в нефтепереработке и в
нефтехимии
Каталитический крекинг
Каталитическим крекингом называют совокупность различных превращений углеводородов, протекающих на кислотных катализаторах (в настоящее время – гетерогенных) с образованием компонентов авиационного и моторного (автомобильного) топлива из высококипящих фракций углеводородов.
Основные реакции:
(1) Деалкилирование (крекинг) парафинов
![]()
(2) Деалкилирование (крекинг) олефинов
![]() (n = m + k)
(n = m + k)
(3) Деалкилирование алкилароматических соединений
![]()
(4) Ароматизация нафтенов
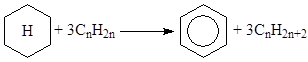
(5) Скелетная и позиционная изомеризация олефинов.
(6) Скелетная изомеризация парафинов
В современных процессах используют аморфные и кристаллические (цеолиты) алюмосиликаты Al2O3 – SiO2. Цеолиты бывают природные и синтетические. Общая формула цеолита
MxDy/2 AlmSinO2(m+n)·PH2O, x + y = m
где M и D – одно- и двухвалентные катионы. В настоящее время только X- и Y- синтетические цеолиты используются для крекинга углеводородов. Эти цеолиты близки природным цеолитам – мордениту (X) и шабазиту (Y). При общей формуле этих цеолитов
NapAlpSi192–pO384·gH2O
для X-цеолита P = 96 – 74, для Y-цеолита P = 74 – 48.
Кристаллическая структура цеолитов характеризуется сквозными порами одинакового диаметра (0.75 – 1.0 нм), превышающими размеры многих молекул углеводородов. При замене части ионов Na+ на ионы NH4+ и последующей прокалки на поверхности цеолита образуются сильные протонные центры
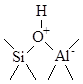
При отщеплении воды ( > 400оС) появляются апротонные кислотные центры Льюиса, локализованные на Al. Высококремнистые и термостабильные цеолиты ZSM-5 относят к очень сильным протонным кислотам (к сверхкислотам).
В основе теории механизмов реакций, протекающих в процессе каталитического крекинга, лежат представления об участии в стадиях механизмов ионов карбения и карбония и, таким образом, химия этих ионов и есть суть механизмов перечисленных выше процессов.
CH3+, R+ CH5+, RH2+
ионы карбения ионы карбония
На поверхности твердых кислотных катализаторов так же, как и в растворах, нет свободных ионов карбения R+. Такие частицы всегда сольватированы в растворах и переносятся на другие реагенты, освобождаясь от молекулы растворителя (как и H+).
![]()
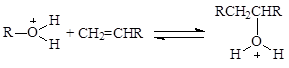
На поверхности кислотных катализаторов можно представить аналогичный процесс “сольватации” (координации) иона карбения поверхностным оксидом
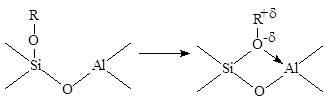
Координированный таким образом R+ аналогичен иону карбения в ионе алкоксония R3O+BF4– и может участвовать в реакциях с другими реагентами (олефинами, спиртами, аренами) аналогично реакциям алкоксониевых ионов в реакции полимеризации циклов (см. раздел 11). Ионы карбония могут находится в свободном состоянии, удерживаясь на поверхности за счет слабых водородных связей или за счет электростатических сил в виде ионных пар RH2+·X–.
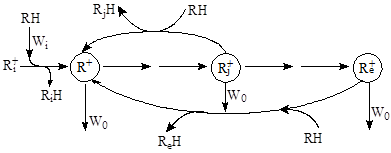
В целом механизм процессов крекинга парафинов, олефинов, скелетной изомеризации парафинов и олефинов, реакций деалкилирования алкиларенов является цепным с кинетической точки зрения. Все эти процессы включают стадии инициирования, зарождения активных центров R+ (Wi), стадии продолжения кинетической цепи с участием ионов карбения и карбония и стадии обрыва активных R+ (W0) за счет примесей в реакционной смеси. Добавки долей процента олефинов к чистому алкану резко ускоряют процесс каталитического крекинга.
Образование кокса на поверхности алюмосиликатных катализаторов (следствие глубокого дегидрирования полимеров) является основной причиной дезактивации катализаторов крекинга, наряду с обратимым отравлением сильно адсорбирующимися примесями и необратимым отравлением металлами, содержащимися в нефтяных фракциях.
