ЭМА с применением электролиза, электрогравиметрия, внешний и внутренний электролиз, кулонометрия
Вместо Zn можно употреблять и другие металлы (Al, Fe, Pb и др.), имеющие потенциал, более отрицательный, чем у выделяемого металла.
Слабый и очень равномерный ток при внутреннем электролизе дает возможность выделять даже чрезвычайно малые количества металла, который покрывает катод очень ровным и плотным слоем.
Главной опасностью при внутреннем электролизе является цементация, т.е. разр
яжение части ионов определяемого металла непосредственно на самой анодной пластинке. Для предотвращения цементации катод отделяют от анода перегородкой (диафрагмой), чаще всего из коллодия, или покрывают анод полупроницаемой пленкой коллодия.
Ю.Ю. Лурье установлено, что при малых количествах (не более 20 мг) определяемого металла диафрагму можно не применять. Во избежание цементации необходимо, чтобы течение тока во время электролиза ни на минуту не прерывалось, и электроды не касались друг друга. Материал анода должен не сдержать примесей, поверхность его должна быть невелика и хорошо отшлифована. Результат анализа получают по привесу платиновой сетки по окончании электролиза. Можно также осевший металл растворить и окончить определение фотометрическим или другим методом.
Кулонометрия - это метод, основанный на измерении количества электричества, израсходованного на электропревращении (восстановлении или окислении) определяемого вещества. Если протекает какая-либо электрохимическая реакция MeZ+ + Ze - Me0, то по количеству электричества, израсходованного на эту реакцию, числу электронов, принимающих в ней участие, можно определить содержание вещества по закону Фарадея.
Необходимыми условиями применения метода является, как и в ЭГМ, 100% -й выход по току и отсутствие конкурирующих реакций.
Электролиз в кулонометрической ячейке можно проводить при постоянной силе тока (гальваностатическая кулонометрия), либо при постоянном потенциале (потенциостатическая кулонометрия). В свою очередь по методике выполнения различают прямую и косвенную кулонометрию (кулонометрическое титрование). Прямые определения обычно проводят при постоянном потенциале рабочего электрода, а косвенные - при постоянной силе тока.
Схема установки для прямой кулонометрии (рис.2.12.1) включает кулонометрическую ячейку 1, источник постоянного напряжения (потенциостат) 2, вольтметр 3. Электролиз ведут до тех пор, пока не закончится электропревращение определяемого вещества на электроде, то есть сила тока, контролируемая амперметром 4, не уменьшится до незначительной величины.
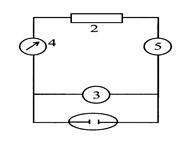
Рис. 1. Схема установки для прямой кулонометрии.
Для измерения количества прошед-шего электричества может служить специальное измерительное устройство - кулонометр. Принцип его действия основан на том, что через этот последовательно включенный прибор протекает такой же ток, какой проходит через анализируемый
раствор и, следовательно, за то же время, то же количество электричества. В кулонометре со 100% -м выходом протекает хорошо известная электрохимическая реакция, и измерение Qх сводится к определению Qст., полученного в результате этого процесса. В зависимости от способа измерения объема, массы вещества различают электрогравиметрические титрационные и другие кулонометры. В газовых кулонометрах определяется масса газа, выделившегося в результате электрохимического процесса. В электрогравиметрических - масса вещества; напри мер, масса меди, выделившейся при электролизе CuSO4 в медных куло нометрах, масса Ag при электролизе AgNO3в серебряных кулонометрах.
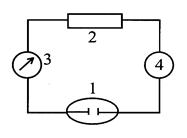
Рис. 2. Схема установки кулонометрического титрования.
При проведении кулонометрического титрования используют уста-новку, включающую ячейку 1, источник постоянного тока (гальваностат) 2, амперметр 3. Время электролиза могут измерять включенным в схему электрохронометром 4 или секундомером (рис.2.12.2).
В основе прямой кулонометрии лежит непосредственное электропревращение определяемого вещества на электроде, поэтому метод пригоден только для определения электроактивных веществ, т.е. веществ, способных окисляться или восстанавливаться на электроде.
Прямые определения проводят при предварительно подобранном постоянном потенциале рабочего электрода, обеспечивающем устранение конкурирующих реакций и 100% -ю эффективность по току. Момент окончания электродной реакции определяют, используя зависимость I = f(t), которая в перемешиваемом растворе выражается уравнением It = I010-Kt, It - сила тока в момент времени t, I0 - в начальный момент; K - константа, зависящая от площади поверхности электрода S, коэффициента диффузии D объема раствора V и толщины диффузионного слоя : K = 0,43 DS/V. Из уравнения следует, что для полного восстановления или окисления определяемого вещества на электроде требуется бесконечно большее время, что практически неосуществимо. Поэтому электролиз ведут не до I = 0, как это требуется для 100% -ного выхода по току, а до достижения небольшого, не изменяющегося в течение времени тока, составляющего 0,01 - 0,001% I0. Для ускорения завершения электролиза используют электроды с большой площадью, малый объем раствора и перемешивание. При правильно выбранных условиях электролиза его время не превышает 0,5 ч.
Прямая кулонометрия - высокочувствительный и точный метод, позволяющий с помощью современных приборов определять до 10-9 г вещества, за время 103с с погрешностью не более 0,5%. Этот метод безэталонный и легко автоматизируемый.
В процессе кулонометрического титрования определяемое вещество реагирует с титрантом, получаемым в результате электрохимической реакции на электроде. Такой титрант называют электрогенерированным, а электрод, на котором его получают - генераторным. Такой титрант можно получить из растворителя, например, воды на катоде:
Н2О + ![]() ½Н2 + ОН - или аноде Н2О - 2
½Н2 + ОН - или аноде Н2О - 2![]() ½О2 + 2Н+.
½О2 + 2Н+.
Электрогенерированные ионы ОН - и Н+ можно использовать для титрования кислот или оснований.
Чаще титрант генерируют из специального вещества, вводимого в ячейку, обычно называемого вспомогательным реагентом (см. таблицу 2.12.1). Реакцию электролиза проводят при I = const.
Для обеспечения 100% выхода по току в ячейку вводят избыток вспомогательного реагента. Если титрант генерируется в количестве, эквивалентном содержанию определяемого вещества, то определив Q, затраченное на получение титранта, можно определить содержание определяемого вещества. Поэтому необходимо иметь надежный способ фиксирования конца титрования. Для этого можно применять химические индикаторы для визуального установления КТТ, так и инструментальные методы, например потенциометрию.
Достоинством кулонометрического титрования является то, что титрант не нужно готовить, хранить и стандартизировать, так как метод безэталонный, абсолютный и позволяет оценить количество определяемого вещества, а не его концентрацию.
Другие рефераты на тему «Физика и энергетика»:
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
