ЭМА с применением электролиза, электрогравиметрия, внешний и внутренний электролиз, кулонометрия
Электрогравиметрия (ЭГМ) является разновидностью гравиметрии. Особенность ЭГМ заключается в осаждении определяемого элемента путем электролиза на предварительно взвешенном электроде. О массе элемента в растворе судят по увеличению массы электрода после электролиза.
ЭГМ применяют для определения металлов из растворов, в которых они присутствуют в виде ионов.
При электролизе катионы пер
емещаются к катоду, выделяясь на нем в виде металлов. Только очень немногие металлы осаждаются на аноде. К ним относятся, например, Mn и Pb, окисляющиеся в процессе электролиза до MnO2 и PbO2.
ЭГМ применяют для определения металлов, дающих плотные осадки на электроде, не осыпающиеся при промывании, высушивании и взвешивании. Кроме того, ЭГМ применяют только в тех случаях, когда осаждение определяемого металла не сопровождается соосаждением других металлов или примесей.
Электроды, применяемые в ЭГМ, должны отвечать следующим требованиям:
1) быть химически инертными;
2) хорошо удерживать образующиеся осадки;
3) иметь возможно меньшую массу и возможно большую поверхность;
4) не препятствовать перемешиванию раствора.
Всем этим требованиям в наибольшей степени удовлетворяют платиновые сетчатые электроды. Анодом, в большинстве случаев, служит платиновая проволока, согнутая в спираль.
Для проведения ЭГМ два платиновых электрода погружают в стакан с анализируемым раствором, подсоединяют электроды к внешнему источнику тока и проводят электролиз. При прохождении тока через раствор электролита происходят процессы восстановления и окисления соответствующих веществ на электродах. Связь между количествами веществ, участвующих в электродных процессах, и количеством электричества Q (Q = It) через цепь за время электролиза t при токе I устанавливается двумя законами Фарадея:
1) масса вещества, выделившаяся при электролизе, пропорциональна количеству электричества, прошедшего через раствор;
2) при прохождении через раствор одного и того же количества электричества на электродах выделяется одно и то же количество вещества эквивалента.
Математически оба закона можно представить формулой
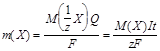 ,
,
где m(X) - масса вещества X, выделившегося при электролизе;
M(1/z X) и M(X) - молярная масса эквивалента и молярная масса вещества X, соответственно;
z - число эквивалентности;
F - число Фарадея, равное количеству электричества (96500 Кл), которое требуется для выделения 1 моль эквивалентов вещества.
Формула позволяет решать различные задачи, связанные с электролизом. Например, вычислить продолжительность при заданной силе тока для выделения определенной массы вещества. На практике электролиз требует больше времени, чем это следует из формулы. Это связано с побочными реакциями, обычно сопровождающими главные. Поэтому КПД тока, иначе называемый выходом по току, почти всегда ниже 100%.
Выход по току может быть определен как отношения массы вещества m, реально полученного при электролизе, к массе вещества, которая могла бы получиться в соответствии с законом Фарадея m0, если бы количество электричества не расходовалось на побочные процессы:
![]() .
.
При прохождении через раствор электрического тока на электродах выделяются продукты электролиза, что приводит к возникновению в системе ЭДС обратной внешней ЭДС источника тока. Это явление называется электрохимической поляризацией, а возникающая обратная ЭДС - ЭДС поляризации. Ее можно заметно уменьшить, прибавляя так называемые деполяризаторы, т.е. вещества, разрежающиеся прежде, чем ионы, которые разрежались бы в их отсутствие.
Таким образом, чтобы электролиз мог происходить, необходимо приложить к электродам напряжение, превышающее ЭДС поляризации. Наименьшее напряжение, которое необходимо приложить к электродам для того, чтобы вызвать непрерывный электролиз данного электролита, называется его напряжением разложения Ер. Ер должно быть больше ЭДС гальванического элемента Е (Е = Еа - Ек) на величину перенапряжения Ер = Е + = (Еа+ a) - (Ек - k), где Еа и Ек - равновесные потенциалы анода и катода, а а и к - перенапряжения на аноде и катоде.
Величина перенапряжения зависит от:
1) плотности тока j = I/S (где S - площадь поверхности электрода). Чем больше j, тем больше ;
2) состояния поверхности электрода: на гладком электроде больше, чем на шершавом, так как при одинаковой силе тока приходящаяся на единицу поверхности плотность тока больше;
3) температуры: повышение температуры уменьшает ;
4) природы электрода и различных примесей в растворе.
При электролизе нужно учитывать силу тока в цепи. Чем больше I, тем больше j и тем больше в единицу времени на поверхности электрода выделится определяемого металла. Следовательно, тем быстрее закончится электролиз и анализ в целом.
Однако при слишком большой j осадок получается рыхлым (губчатым), непрочно связанным с электродом. Причина этого в том, что при слишком большой j скорость разрядки ионов определяемого металла становится больше скорости их подвода к электроду. Поэтому раствор около катода начинает настолько обедняться ионами, что на катоде начинает восстанавливаться водород, пузырьки которого разрыхляют осадок. Введение комплексообразующих компонентов предотвращает выделение водорода и способствует получению прочных однородных осадков металлов.
Многие металлы, например Zn, Sn, Pb, при низких плотностях тока выделяются в виде непрочного слоя. Предполагается, что причина этого - присутствие в электролите растворенного кислорода и примесей окислителя.
Условия электролиза должны быть выбраны так, чтобы происходило выделение только одного металла, а не их смеси, и чтобы выход по току составлял 100%.
После электролиза электроды промывают несколько раз дистиллированной водой, не отключая электроды от источника тока, затем сушат и точно взвешивают. По разности масс электродов, без осадка и с ним, находят массу определяемого вещества в растворе.
Внутренний электролиз ЭГМ можно выполнить в накоротко замкнутом гальваническом элементе. При этом не требуется внешнего источника тока, так как осадок выделяется за счет энергии гальванического элемента. Такой вариант ЭГМ называют внутренним электролизом.
Например, ионы Cu2+ будут количественно выделяться из раствора на платиновом сетчатом катоде, если этот электрод соединить с цинковым анодом. В полученном таким образом гальваническом элементе Zn, имеющий меньший окислительный потенциал, переходит в раствор, отдавая электроны:
Zn - 2![]() Zn2+.
Zn2+.
Высвобождающиеся при этом электроны переходят по проводу к платиновому электроду, который передает их Cu2+-ионам, восстанавливая их до металлической меди, оседающей на платиновой сетке:
Cu2+ + 2![]() Cu .
Cu .
Другие рефераты на тему «Физика и энергетика»:
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
