Изучение вопросов биотехнологии в курсе химии средней школы
Другой подход, используемый для получения нужных генов, состоит в конструировании на мРНК-матрице комплементарной по отношению к ней ДНК (кДНК) [11].Теперь специфическую мРНК, кодирующую белок, ген которого надо получить, можно использовать в качестве матрицы для ферментативного синтеза кДНК с помощью обратной транскриптазы (ревертазы). (рис. 5).
После расщепления гибрида ДНК-РНК, используя
видоизменённую протеазами ДНК-полимеразу E.coli – фрагмент Клёнова, синтезируют двухцепочечную ДНК.
После расщепления «шпильки» остается синтетическая двуцепочечная кДНК, соответствующая белку, кодируемому интересующим нас геном. Заметим, однако, что если эту синтетическую кДНК получали с эукариотической мРНК, то она не идентична природному гену этого белка, поскольку не содержит ни интронов, т.е. вставочных последовательностей, ни стартовых и терминирующих сигналов, присущих генам большинства эукариотических белков. И для экспрессии такого гена в клетках прокариот необходимо, чтобы он находился под контролем прокариотических регуляторных элементов. В связи с этим для осуществления экспрессии соответствующая кДНК присоединяется к регуляторным элементам бактерии-промотору, оператору и рибосом-связывающему участку.
На современном этапе также возможен химико-ферментативный синтез полинуклеотидных последовательностей. Синтез гена впервые был осуществлён в 1970 году в лаборатории Х.Г. Кораны.
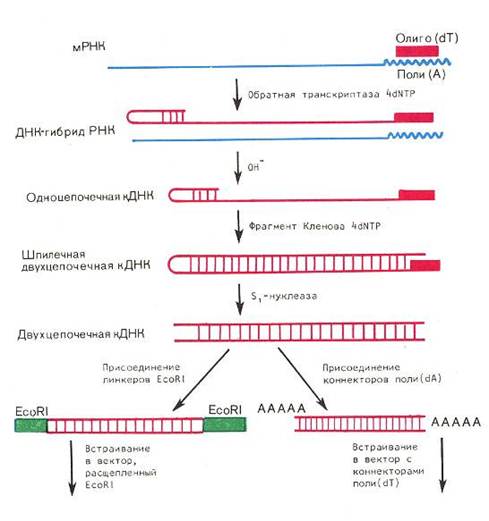
Рис. 5. Схема подготовки кДНК для клонирования[14].
Клонирование и экспрессия генов в различных организмах
В настоящее время разработаны системы клонирования в бактериях, дрожжах, грибах, растениях и млекопитающих. Особый интерес с экономической точки зрения представляют системы клонирования генов в грамположительных бактериях, многие из которых являются сверхпродуцентами важнейших химических соединений[7]. Значительных успехов в биоиндустрии удалось достичь с клетками Bacillus subtilis, стрептомиценами и Sacchromyces cerevisiae.
Векторы для клонирования в таких системах представляют собой двойные репликоны, способные существовать и в E.coli, и в той клетке хозяина, для которой они предназначены. С этой целью создают гибридные векторы, содержащие репликон какой-либо из плазмид E.coli и требуемый репликон (из бактерий, дрожжей и др.), и первоначально клонируют с последующим отбором требуемых генов в хорошо изученной системе. Затем выделенные рекомбинантные плазмиды вводят в новый организм.
Инсулин – гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний – сахарному диабету.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г. кристаллического инсулина необходимо 800–1000 кг исходного сырья. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках E.coli (рис. 6).
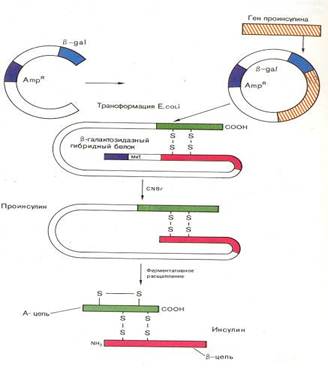
Рис. 6. Экспрессия гена проинсулина человека в составе гибридного белка с β-галактозидазой[14]
Был синтезирован и ген соматостатина – гормона гипоталамуса. Соматостатин подавляет выделение инсулина и гормона роста человека. В Национальном медицинском центре «Хоуп» (Калифорния) был осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Синтетический ген соматостатина был встроен в плазмиду pBR322 E.coli вблизи конца гена, кодирующего фермент β-галактозидазу. Между двумя генами был помещен кодон метионина. После введения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от β-галактозидазы BrCN. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10 000 молекул на одну клетку. Из 100 г. биомассы E.coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 кг овечьих мозгов.
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза. Его недостаток приводит к заболеванию – гипофизарной карликовости (1 случай на 5000 человек). Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Препарат из трупного материала представляет собой смесь из нескольких форм. Это приводило к тому, что у 30% больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность. Принимая во внимание это обстоятельство, в настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Биосинтез ГРЧ был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку.
Проблема введения генов в клетки млекопитающих очень важна для исследования функционирования генов высших эукариот[7].
Предварительно клонированные гены вводят в клетку животных различными путями. Суть одного из них состоит в трансформации клеток требуемым геном, соединенным с одним из генов, для которых осуществляется селекция. Для идентификации и последующего размножения клеток, содержащих интегрированную ДНК, был разработан метод, получивший название метода маркера. Примером может служить метод получения клеток, дефектных по синтезу фермента тимидинкиназы (ТК--клетки). Такие клетки трансформировались фрагментами ДНК вируса герпеса (HSV), содержащего ген фермента ТК, и после трансформации они приобретали способность к синтезу фермента на селективной среде, т.е. становились ТК+-клетками. Клетки ТК+ легко отличаются от клеток ТК-, поскольку способны расти на средах с аминоптерином (ингибитор, блокирующий определенные стадии биосинтеза нуклеотидов). Следовательно, в данном случае для трансформации клеток животных были использованы гибриды бактериальных плазмид с геном ТК из вируса герпеса. Для этого предварительно проводили клонирование и идентификацию генов в клетках E.coli и затем полученная рекомбинантная плазмида вводилась в ТК–клетки.
Представляют немаловажный интерес микроинъекции ДНК непосредственно в ядро клетки. Её осуществляют с помощью специальной пипетки (внутренний диаметр её около 1 мкм), а количество инъецированного раствора ДНК составляет 1–2 пкл. Так, плазмиды, содержащие фрагмент вируса герпеса с геном тимидинкиназы, и плазмиды pBR322 были инъецированы в ТК-клетки, при этом ТК-ген проник в ядра и нормально в них реплицировался. Микроинъекцию клонированных генов проводят в один или оба пронуклеуса только что оплодотворенной яйцеклетки мыши. После инъекции яйцеклетку немедленно имплантируют в яйцевод приемной матери или дают возможность развиваться в культуре до стадии бластоцисты, после чего имплантируют в матку. Таким образом, были инъецированы гены интерферона и инсулина человека, ген глобина кролика, ген тимидинкиназного вируса герпеса и кДНК вируса лейкемии мышей. Несмотря на определенные успехи в области интеграции чужеродных генов в эмбриональные клетки животных, до сих пор не удалось встроить чужеродную ДНК в заданный участок хромосомы, вытеснить ген и заменить его новой нуклеотидной последовательность, подчинить новый ген системе регуляции организма.
Другие рефераты на тему «Педагогика»:
- Обучение детей младшего дошкольного возраста правильному произношению звуков
- Реформа высшей школы глазами студентов и преподавателей
- Тема "Разрезы" в школьном курсе черчения и её влияние на развитие пространственного мышления
- Методы работы над сказкой
- Пути обновления системы повышения квалификации педагогических работников в РК
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
