Динамическое поведение мембранных систем и липидно-белковые взаимодействия
В некоторых случаях были зарегистрированы дополнительные индуцированные белком фазовые переходы в липидах. Возможно, эти липиды содержатся в обогащенных белками доменах, а может быть, наблюдаемый эффект связан с влиянием изолированных белковых молекул белка на липиды, не принадлежащие пограничному слою.
Влияние белков на полиморфизм фосфолипидов
Некоторые белки оказывают сильное влияние
на полиморфизм фосфолипидов, стабилизируя ламеллярные или гексагональные формы. Этот факт представляет интерес в связи с гипотезой о том, что инвертированные гексагональные цилиндры или липидные частицы играют какую-то роль в перемещении липидов через мембранный бислой и в слиянии мембран. В присутствии гидрофобного полипептида грамицидина А при соотношении липид/ белок, равном 10:1, диолеилфосфатидилхолин переходит из бислойной структуры в гексагональную Нц-фазу. При этом, по-видимому, происходит агрегация грамицидина и последующая дегидратация липидов, стабилизирующая гексагональную фазу. Напротив, гликофорин стабилизирует бислойную конфигурацию диолеилфосфатидилэтаноламина, в то время как обычно этот липид находится в гексагональной Нц-фазе. На полиморфизм кардиолипина влияют положительно заряженные белки, например кардиотоксин, цитохром с. В связывании кардиотоксина участвуют как электростатические, так и гидрофобные силы, как и в случае белков, связывающихся с поверхностью мембраны.
Возможная роль упругих деформаций бислоя, обусловленных белками
Искажения в структуре бислоя, о которых шла речь в предыдущем разделе, в большинстве своем возникают при точном соответствии ацильных цепей липидов форме белковой молекулы, при этом налагаются некоторые ограничения на определенные быстрые движения липидных молекул, соседствующих с белком. Такие искажения распространяются на очень небольшие расстояния, лишь немного выходя за рамки пограничного слоя. Интересно было бы рассмотреть более серьезные возмущения, при которых белки, встраиваясь в бислой, производят более существенные изменения в липидном бислое. Некоторые возмущения такого рода представлены на рис. 5.7. В принципе деформации, индуцируемые в бислое, могут распространяться на значительные расстояния, так реорганизуя липиды и/или белковые компоненты, что система переходит в наиболее стабильное состояние. Было разработано несколько теоретических подходов к исследованию этого вопроса, но, к сожалению, экспериментальные данные весьма немногочисленны.
1. Белок в форме клина или белок, проникающий только в один монослой, изменяет наклон ацильных цепей липидных молекул в одном или обоих слоях мембраны. Это изменение может распространяться на большие расстояния от белка и влиять на взаимодействия липидов с другими мембранными белками. Возникающие при этом напряжения в бислое могут сниматься благодаря реорганизации липидов. Например, липиды с относительно небольшими полярными головками могут группироваться вокруг белковой молекулы. Одним из преимуществ многокомпетентности мембраны может быть оптимизация упаковки липидов
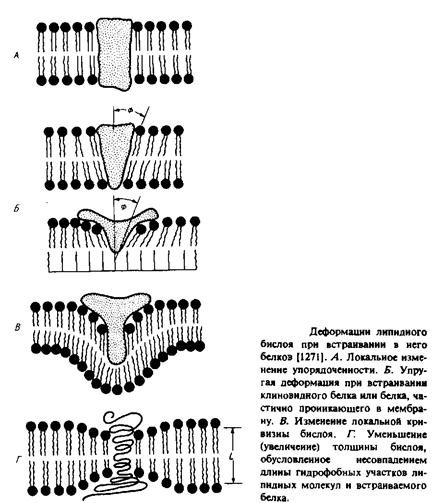
вокруг отдельных мембранных белков, уменьшающая возможные деформации на границе белок—липид.
2.Другой тип деформаций, возникающих при встраивании белка в мембрану, — это латеральные искривления. Примером такого белка может служить «непрочно» связывающаяся форма цитохрома.
3.Еще одной причиной деформаций бислоя может служить несоответствие между размером данного гидрофобного участка бислоя и толщиной мембраны. Чтобы избежать экспонирования гидрофобных областей в воду, белок или липиды могут частично изменить свою конформацию. Если белок не деформируется, то может произойти следующее: а) или ацильные цепи, или белковая молекула наклоняются относительно нормали к бислою на угол, зависящий от толщины мембраны. Это предположение было в одном случае подвергнуто проверке и не нашло подтверждения; б) ацильные цепи липидов деформируются; в) в гетерогенной смеси липидов последние реорганизуются таким образом, что молекулы «неправильной» длины оказываются сгруппированными вокруг белка.
В принципе подобные упругие деформации могут индуцировать специфические взаимодействия липидов с определенными белками для уменьшения искажений в структуре бислоя путем подгонки формы и размера этих молекул, а не за счет специфических химических взаимодействий. Однако эксперментальные данные на этот счет отсутствуют. Кроме того, простирающиеся на большие расстояния деформации могут влиять на белок-белковые ассоциаты. Экспериментальные подтверждения этому были получены в результате наблюдения с помощью электронной микроскопии за распределением бактериородопсина и родопсина в реконструированных фосфолипидных везикулах при разной толщине мембраны. Адаптированный к темноте родопсин действительно агрегировал в результате изменения наклона ацильных цепей липидов при внедрении фермента в бислой, слишком толстый для идеальной упаковки вокруг белка.
5.3 Динамические свойства остова мембранных белков и их боковых цепей
Проводя ЯМР-исследования твердых образцов, можно получить детальную информацию о динамических свойствах отдельных аминокислотных остатков мембранных белков. Однако при этом необходимы большие количества препарата равномерно меченного белка. Наиболее информативным этот метод является в случае небольших белков, когда можно проводить спектроскопические измерения. Возможности этих методов иллюстрируют работы по исследованию белков оболочки нитевидных бактериофагов. При вирусной инфекции эти белки встраиваются в плазматическую мембрану Е. соН с помощью единственной трансмембранной спирали, а во время сборки фага липиды и белки клетки-хозяина исключаются из его оболочки. Малый размер белков оболочки, возможность получения их в больших количествах и легкость выделения создают значительные преимущества при их изучении методом ЯМР, а также другими методами.
Для исследования динамических свойств аминокислотных остатков белка оболочки фага fd в реконструированных фосфолипидных бислоях использовались методы 2Н- и 15N-flMP. Результаты показали, что полипептидный остов на участке от 5-го до 43-го остатков включительно относительно жесткий, при этом данный сегмент превосходит по длине участок, находящийся внутри липидного бислоя. Несколько остатков на концах полипептида свободны и могут совершать движения с большой амплитудой. Большинство боковых цепей в состоянии совершать такие движения, даже когда соответствующие остатки находятся внутри бислоя.
Работы, в которых использовались упомянутые методы, слишком немногочисленны для того, чтобы можно было составить полное представление о характере влияния липидно-белковых взаимодействий на внутреннюю динамику мембранных белков.
5.4 Связывание периферических мембранных белков с липидным бислоем
При изучении липидно-белковых взаимодействий основное внимание уделялось трансмембранным белкам, однако в последнее время проявляется все больший интерес к связыванию с бислоем периферических мембранных белков. Многие такие белки связываются с мембраной главным образом через взаимодействие с интегральными белками. Но существует большая группа разнообразных белков, которые связываются непосредственно с поверхностью липидного бислоя. Некоторые из этих белков, например основный белок миелиновой оболочки, спектрин и матриксный белок вируса везикулярного стоматита, играют в основном структурную роль. Множество растворимых белков связываются с поверхностью мембраны на непродолжительное время или при специфических условиях. В некоторых случаях связывание белка является необходимым условием проявления его ферментативной активности; такими белками являются, например, протеинкиназа С, факторы свертывания крови, пируватоксидаза. Еще одним примером белков, связывающихся с поверхностью бислоя, служат амфифильные пептидные гормоны и, возможно, сигнальные последовательности, которые ответственны за перемещение секретируемых или мембранных белков в нужное место.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
