Динамическое поведение мембранных систем и липидно-белковые взаимодействия
Для того чтобы разграничить динамические эффекты и эффекты, связанные с ограничениями, налагаемыми на диапазон допустимых движений, определяют временную зависимость анизотропии r света, испускаемого молекулой после возбуждения. Значение г в данный момент времени отражает степень разу-порядочивания молекул относительно вектора поляризации за вре- ■ мя, прошедшее после поглощения возбуждающ
его импульса света. Спад r от максимального значения го задается выражением
![]()
тк — время вращательной корреляции, оно определяется скоростью затухания. Если при / оо все молекулы окажутся беспорядочно ориентированными, то л в пределе будет равно нулю. Однако если движение молекул ограничено, то их ориентация никогда не будет совершенно случайной. В такой ситуации г» не будет равно нулю, и с помощью этого параметра можно определить степень ограничения, которое налагается на подвижность зонда его окружением. Параметр упорядоченности определяется из этих величин так же, как в случае ЭПР или ЯМР:
![]()
К сожалению, такие кинетические измерения проводятся редко, большинство экспериментов выполнено в стационарном режиме при непрерывном возбуждении и испускании. Значение г, полученное таким способом, носит усредненный характер и определяется как
![]()
Рассмотрим следующие три случая.
1. Очень быстрое движение: 7"= г„, предельному значению.
2. Очень медленное движение или его отсутствие: г = го, максимальному значению.
3. Случаи, представляющие практический интерес '- 7 зависит как от скорости движений, так и от ограничений, налагаемых на них.
Без соответствующей корректировки определение микровязкости по результатам измерений 7 не будет сводиться к простым динамическим измерениям.
Вязкость бислоя весьма высока, поэтому время вращательной корреляции небольших флуоресцентных и ЭПР-зондов составляет 10~8—10 с. В воде, имеющей вязкость 0,01 пуаз, молекулы такого размера вращались бы по крайней мере в 100 раз быстрее. Мембранные белки имеют значительно большие размеры, чем упомянутые метки, и поэтому вращаются гораздо медленнее. Чтобы метки, «пришитые» к этим белкам, были чувствительны к их вращению, время жизни меток в возбужденном состоянии должно составлять порядка 10~3 с.
3. Вращение мембранных белков
Коэффициент вращательной диффузии мембранного белка, находящегося в плоскости бислоя, D., можно найти, представив белко
вую молекулу в виде цилиндра, который вращается вокрут одной оси. Пусть мембрана имеет вязкость г) и толщину h, а радиус цилиндра равен а. Тогда
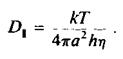
Часто наряду с фу применяется время вращательной релаксации ф, = 1/. Для белковой молекулы радиусом 25 А, находящейся в мембране толщиной 40 А и вязкостью 5 пуаз, величина ф, по оценкам составляет около 35 мкс. С количественной точки зрения это уравнение, описывающее вращение белка в бислое, не вполне строго, но зависимость времени вращательной релаксации от эффективного радиуса вращающейся белковой молекулы сомнений не вызывает. Это оказалось весьма полезным для исследования процессов агрегации белков внутри мембраны. Методы, применяемые для изучения вращения белков в бислое, должны быть способны регистрировать времена вращения от 10"5 до 10 ~3 с. Обычный метод измерения деполяризации флуоресценции в этом случае непригоден, поскольку время жизни молекул в возбужденном состоянии составляет около 10"8 с, и в таком временном масштабе молекулы белков представляются неподвижными. Успешно использовались три метода.
1. К исследуемому белку присоединяют зонд, время жизни которого в возбужденном триплетном состоянии достаточно велико. Если метка жестко связана с белком, то для регистрации вращения белка можно использовать измерение анизотропии фосфоресценции. Для таких измерений оказались пригодными производные эозина, поскольку время жизни эозина в триплетном состоянии составляет примерно 2 мс. В основе этого подхода лежат те же принципы, что и в основе метода деполяризации флуоресценции, но используется другая молекулярная модель движения, вызывающего деполяризацию. Эксперимент состоит в определении характерного времени затухания анизотропии фосфоресценции. Если система гетерогенна, могут возникнуть определенные трудности, связанные с количественным анализом экспоненциальной кривой затухания анизотропии. Проблемы возникают и в тех случаях, если метка может локально вращаться на поверхности мембранного белка или если у белковой молекулы имеются гибкие сегменты.
Те же метки могут использоваться и для анализа вращения белков с использованием временной зависимости дихроизма поглощения. В этом случае изменения в ориентации дипольного момента перехода регистрируются по поглощению света, поляризованного параллельно и перпендикулярно оси поляризации начального импульса, используемого для возбуждения молекул.
2. Известны случаи, когда сами молекулы белка содержат группы, переходящие при флеш-фотолизе в долгоживущее возбужденное состояние, параметры которого можно оценить с помощью дихроизма поглощения. В качестве примера можно привести родопсин и бактериородопсин, где используются возбужденное состояние связанного ретиналя и возбужденные состояния, наблюдающиеся при фотолизе комплексов цитохром—СО с использованием цитохром с-оксидазы и цитохрома Р450. Измерения можно проводить in situ или с очищенным белком, встроенным в фосфолипидные везикулы.
3. С помощью обычной ЭПР-спектроскопии не удается регистрировать вращения, характерная частота которых равна частоте вращения мембранных белков. Однако разработан специальный метод — ЭПР с переносом насыщения, диапазон чувствительности которого очень широк — от 10"7 до 10 ~J с. Этот метод применялся при изучении вращения нескольких мембранных белков с ковалентно пришитыми к ним спиновыми метками. Недостаток метода состоит в том, что в случае анизотропного молекулярного движения спектры с трудом поддаются интерпретации.
3.1 Примеры вращения белков
Внутримембранные белки характеризуются широким спектром времен вращательной релаксации. На одном конце временной шкалы находится родопсин, который, по-видимому, свободно вращается в мембране наружного сегмента палочки сетчатки, а на другом — бактериородописин, который образует в пурпурной мембране упорядоченную кристаллическую решетку и неподвижен. Для нескольких очищенных белков, встроенных в фосфолипидные везикулы, зависит от концентрации. Это позволяет предположить, что при уменьшении соотношения липид/белок происходит самоагрегация этих белков. Такая картина характерна для бактериородопсина, цитохром с-оксидазы, белка полосы 3, Са2 + -АТРазы и цитохрома Р450. Возможно, именно с самоагрегацией связана гетерогенность, наблюдаемая, в частности, для белка полосы 3 в тенях эритроцитов и Са2 + -АТРазы из саркоплазматического ретикулума. Вообще говоря, мембранные белки, по-видимому, вращаются в плоскости мембраны и скорость вращения согласуется с величиной, ожидаемой исходя из простой гидродинамической модели.
Другие рефераты на тему «Биология и естествознание»:
- Понятие радиоактивного распада. Методы регистрации ионизирующих излучений. Биологическое воздействие излучений на организм
- Биологические ритмы
- Изучение численности отдельных физиологических групп почвенных микроорганизмов в зависимости от антропогенной нагрузки
- Биосфера и человек
- Модификационная изменчивость
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
