Динамическое поведение мембранных систем и липидно-белковые взаимодействия
5.1 Связывание липидов с внутримембранными белками в бислое
Этой теме были посвящены многочисленные исследования, в которых использовались разнообразные подходы. По существу во всех этих работах ставилась задача выяснить, есть ли у белков участки, специфически взаимодействующие с определенными липидами, и можно ли считать белково-липидные комплексы долгоживущими, т. е. обладают ли они време
нем жизни, сравнимым с временем оборота типичного фермента. Такие исследования проводились с помощью Н-ЯМР, ЭПР и флуоресцентных методов. Чтобы разобраться в полученных результатах, полезно рассмотреть термодинамику простой реакции обмена, где липид одного типа вытесняется с места связывания на белке другим липидом:
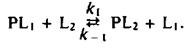
Константа равновесия этой реакции равна
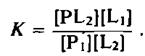
Она является относительной константой связывания липидов Li и L2 с данным участком белковой молекулы, причем
![]()
Если липиды двух типов присутствуют в мембране в одинаковой концентрации и сродство их к белку одинаково, то К = 1. Рассмотрим гипотетический случай, когда L2 является минорным липидным компонентом и составляет только 5°/о от общего количества липидов. Тогда
![]()
Предположим, что L2 предпочтительно связывается с неким участком белковой молекулы, так что в равновесии 90% участков занято L.2. Тогда
![]()
Следовательно, К = 171, что соответствует величине ДС° = = -3,1 ккал/моль. Столь небольшого различия в свободной энергии связывания оказывается достаточно для существенного смещения распределения липидов, связанных с белком, от равновесного состояния. Это обусловлено тем, что соотношение эффективных концентраций конкурирующих липидов в мембране относительно мало: не превышает 100, а в большинстве случаев гораздо меньше. Другими словами, даже минорные липиды присутствуют в мембране в концентрации, составляющей не менее 1% от концентрации основных липидов, с которыми они конкурируют за места связывания на белках.
Для оценки относительного сродства липидов к специфическим белкам используют два подхода. Они основаны на применении липидных аналогов, встроенных в фосфолипидные везикулы, которые содержат интересующий исследователя белок.
1. Спин-меченные фосфолипиды, соседствующие с мембранными белками, обладают ограниченной подвижностью. Это проявляется в уширении спектра ЭПР. У тех молекул ЭПР-зонда, которые соседствуют с белком, возможность движения с характерной частотой > 108 с" 1 существенно ограничена. Спектр ЭПР в этом случае может быть представлен в виде суммы двух компонент: компоненты с узкими спектральными линиями, соответствующей основной липидной фазе, и компоненты, отвечающей липидам с ограниченной подвижностью. Для того чтобы эта последняя была в спектре преобладающей, отношение белок/липид должно быть достаточно высоким. Осложняет картину то, что липиды могут попадать в «ловушки» из белковых агрегатов. Такие липиды тоже обладают ограниченной подвижностью, и им соответствует третья компонента в спектре ЭПР. Для выявления попавших в ловушку липидов при высоких концентрациях белка можно использовать липидные спиновые зонды, ковалентно связанные с поверхностью белка.
2. Спин-меченные и бромированные липидные производные способны тушить флуоресценцию триптофана, входящего в состав мембранных белков. Эффективность тушения зависит от расстояния между липидным производным и остатком триптофана, и присутствие таких липидов в слое, непосредственно прилегающем к белку, приведет к тушению флуоресценции белка. Относительную способность этих липидов связываться с белком в присутствии различных конкурирующих липидов можно исследовать путем измерения интенсивности флуоресценции белка.
Анализ экспериментальных данных, но на практике такие измерения трудно осуществить. Как правило, считается, что все места связывания одинаковы. В одном из вариантов исследуют связывание небольшого количества спин-меченного липида данного типа в присутствии большого количества липида другого типа. При этом снимаются спектры образцов с разным соотношением между липидами и белками. В предположении, что имеется N одинаковых мест связывания, выполняется следующее соотношение. Трудности здесь могут возникнуть из-за гетерогенности мест связывания как по сродству к липидам, так и по способности связанных липидов тушить флуоресценцию триптофана. Однако флуоресцентный метод имеет то преимущество, что при высоких значениях отношения липид/белок агрегация белка создает меньшие проблемы, чем при использовании метода ЭПР.
Необходимо помнить, что ни один из методов, используемых для нахождения относительных констант связывания липидов с мембранными белками, не пригоден для определения небольших количеств мест связывания с высоким сродством, поэтому тот факт, что такие места этими методами не обнаружены, вовсе не означает, что они отсутствуют.
Некоторые белки проявляют избирательность при связывании с фосфолипидами, несущими различные полярные головки
Избирательность связывания с липидами была изучена только для небольшого числа белков, в частности для цитохром с-оксидазы митохондрий, Na+/К+ -АТРазы, Са2 + -АТРазы из саркоплазматического ретикулума и родопсина позвоночных у животных. Как правило, избирательность связывания весьма слаба, при этом максимальное значение К близко к 5. Тем не менее, этого достаточно для того, чтобы имелось значительное различие в связывании липидов с разными белками, зависящее от концентрации липидов разных типов, присутствующих в мембране.
1.Одна молекула родопсина связывается примерно с 24 липидными молекулами, отдавая лишь очень небольшое предпочтение кардиолипину перед фосфатидилхолином.
2.Ыа + /К+-АТРаза из Squalus acanthus связывается примерно с 60 фосфолипидными молекулами, отдавая предпочтение отрицательно заряженным липидам по сравнению с фосфатидилхолином: для кардиолипина К = 3,8, для фосфа-тидилсерина К = 1,7, для фосфатидной кислоты К = 1,5. Фосфатидилэтаноламин и фосфатидилглицерол связываются с этим белком с одинаковым сродством. Предпочтение кислым липидам не может быть обусловлено чисто электростатическими эффектами. Какова биохимическая роль такого предпочтения — неизвестно.
3.Цитохром с-оксидаза связывает от 40 до 55 молекул липидов. Этот фермент отдает предпочтение кардиолипину по сравнению с фосфатидилхолином. Как правило, при очистке митохондриальной цитохром с-оксидазы она выделяется вместе с кардиолипином. Высказывалось предположение, что у этого фермента имеется небольшое число мест связывания, обладающих высоким сродством к этому липиду, и что последний необходим для обеспечения его каталитической активности. Для выяснения биологической роли предпочтительного связывания кардиолипина необходимо провести дальнейшие исследования. Кроме того, поскольку кардиолипин является димерным фосфолипидом, возникают трудности при анализе данных по конкурентному связыванию.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
