Одно- и многоатомные спирты
Алифатические спирты - это соединения, содержащие гидроксильную группу (-ОН), связанную с sp3-гибридизованным атомом углерода. Спирты можно разделить на три большие группы: простые спирты, стерины и углеводы. Рассмотрим простые спирты, с общей формулой CnH2n+1OH.
методы получения спиртов
1. Гидролиз галогеналканов в водных растворах щелочей

Реакция замещения галогена на ОН-группу протекает по механизму нуклеофильного замещения SN. В зависимости от строения субстрата замещение протекает по SN1 (мономолекулярное замещение):
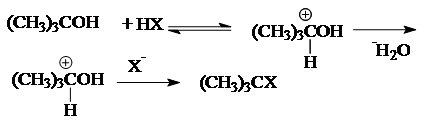
или SN2 (бимолекулярное):
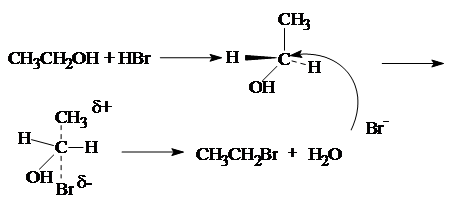
Атакующий агент – анионы (SH -, OН -, I -, Br -, С l -, F -, RO -, CH3COO -, ONO2-) или молекула (ROH, HOH, NH3, RNH2). По увеличению реакционной способности анионы располагаются в следующий ряд:
HS -, RS - > I - > Br - > RO - > Cl - > CH3COO - > ONO2-
Анионы более сильные нуклеофилы, чем сопряженные кислоты:
OH - > HOH, RS - > RSH, RO - > ROH, Cl - >HCl
Нуклеофил – атом (или частица), который может отдать пару электронов любому элементу, кроме водорода. Механизм бимолекулярного нуклеофильного замещения (SN2) включает образование промежуточного комплекса.
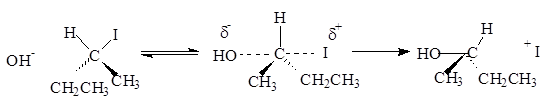
Представленная реакция является реакцией замещения, так как нуклеофил (ОН -) вытесняет уходящую группу (I-).
Механизм мономолекулярного нуклеофильного замещения (SN1) состоит из двух стадий:
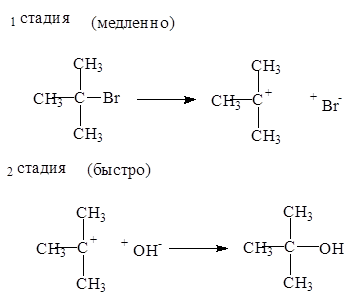
Реакции замещения по механизму SN1 в тех случаях, когда образуется стабильный катион. Первичные галогеналканы реагируют по механизму SN2 , а третичные - по механизму SN1.
2. Гидратация алкенов.
Присоединение воды к алкену протекает в присутствии кислотных катализаторов (H2SO4, H3PO4, оксид алюминия и другие носители, обработанные кислотами).
Реакция протекает по карбоний-ионному механизму:
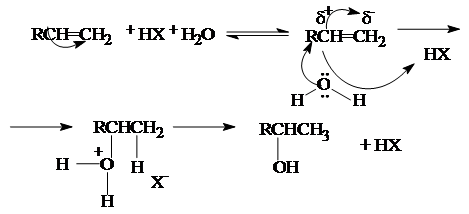
3. Восстановление карбонильных соединений (кетонов и альдегидов)
Альдегиды и кетоны легко восстанавливаются водородом в присутствии катализаторов (например, Ni, Pd, Pt) в соответствующие первичные и вторичные спирты:
CH3-CH2-COH + H2 ® CH3-CH2-CH2-OH
пропионовый альдегид пропанол-1
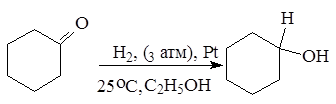
циклогексанон циклогексанол
Для восстановления карбонильной группы используются комплексные гидриды металлов - борогидрид натрия NaBH4 (растворитель - вода, этанол) или алюмогидрид лития LiAlH4 (растворитель - абсолютный эфир):
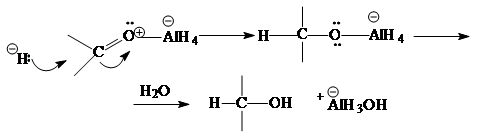
CH3COCH3 + LiAlH4 ® (CH3)2-CHOH
CH3-CHO + NaBH4 ® CH3-CH2-OH
Сложные эфиры также восстанавливаются алюмогидридом лития, причем оба фрагмента эфира превращаются в спирты:
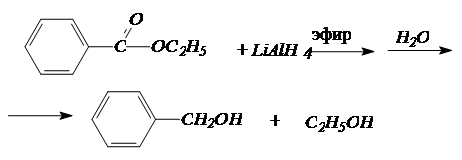
4. Синтезы спиртов с использованием реактивов Гриньяра.
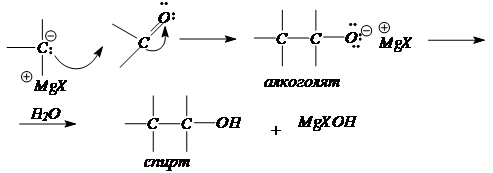
RMgHal + H2C=O (формальдегид) ® RCH2O -Mg+Hal + H2O ® R-CH2-OH
RMgHal + R’HC=O (альдегид) ® R( R’)CHO -Mg+Hal + H2O ® R(R’)CH-OH
RMgHal + (R’)2C=O (кетон) ® R( R’)2CO -Mg+Hal + H2O ® R(R’)2C-OH
По механизму это реакция нуклеофильного присоединения к карбонильной группе.
Промышленные методы получения спиртов.
1. Окисление алканов (синтез спиртов С10-С20).
3 RCH2-OH + B(OH)3 « B(OHC2R)3 + 3 H2O
2. Гидратация алкенов.
R-CH=CH2 + H2O « R-CH (OH)-CH3
CH2=CH2 + H2O ® CH3CH2OH
из пропилена и н-бутилена - изопропиловый и н-бутиловый спирты:
CH3-CH=CH2 + H2O ® CH3-CH (OH)-CH3
CH3-CH2-CH=CH2 + H2O ® CH3-CH2-CH (OH)-CH3
а из изобутилена - трет-бутиловый спирт:
(CH3)2C=CH2 + H2O ® (CH3)3C-OH
Электрофильный механизм гидратации определяет уже отмеченное выше направление присоединения (правило марковникова), а также изменение реакционной способности алкенов в ряду, определяемом сравнительной стабильностью образующихся карбокатионов:
(CH3)2CH=CH2 >> CH3-CH2-CH=CH2 > CH3-CH=CH2 >> CH2=CH2
3. Синтез спиртов по методу Фишера-Тропша.
СО + 2Н2 « СН3ОН
4. Процесс оксосинтеза.
CH2=CH2 + CO + H2 ® CH3-CH2-CHO
Химические свойства спиртов
Обусловлены способностью гидроксильной группы образовывать межмолекулярные водородные связи.
1. Кислотные и основные свойства спиртов.
CH3-OH + HNO3 ¨ CH3-ONO2 + H2O
CH3CH2OH + H2SO4 ® CH3CH2OSO3H + H2O
CH3CH2OH + (CH3CO)2O ® CH3COOC2H5 + CH3COOH
Это – реакции замещения водорода на кислотный остаток.
2. Замещение гидроксильной группы на галоген.
CH3CH2OH + HBr « CH3CH2Br + H2O
Реакция протекает по механизму нуклеофильного замещения.
CH3CH2-OH + SOCl2 ® CH3CH2-Cl + SO2+ HCl
3CH3CH2-OH + PCl3 ® 3CH3CH2-Cl + H3PO4
Ниже приводится механизм взаимодействия спирта с тионилхлоридом:
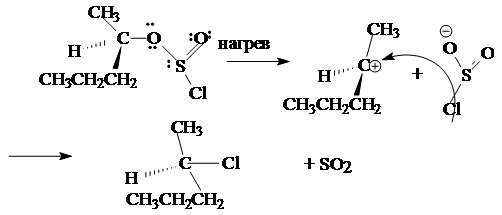
Этот механизм обозначается символом Sni (замещение нуклеофильное внутримолекулярное).
Реакции отщепления
CH3CH2OH ® CH2=CH2
В качестве катализаторов используют минеральные кислоты (серная, фосфорная), кислые соли (KHSO4), ангидриды кислот (Р2О5), оксид алюминия и т.д.
R-OH + R’-OH ® ROR (ROR’, R’OR’) + H2O
Порядок отщепления воды в большинстве случаев определяется
правилом зайцева: при отщеплении воды наиболее легко отщепляет водород от соседнего наименее гидрированного атома углерода.
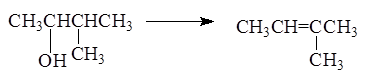
Реакция отщепления воды от спиртов протекает через стадию образования карбкатиона:
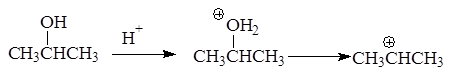
В зависимости от строения спирта образуются первичные, вторичные и третичные карбкатионы:
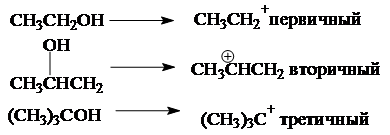
По увеличению стабильности катионы располагаются в следующий ряд: CH3CH2+ < CH3CH+CH3 < (CH3)3C+
Любое влияние, делокализующее положительный заряд карбкатиона, ведет к его стабилизации. Мы имеем дело в данном ряду с индукционной стабилизацией:
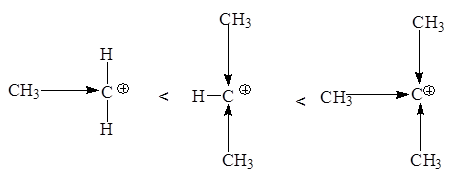
Образующиеся катионы в зависимости от их строения способны к перегруппировкам:
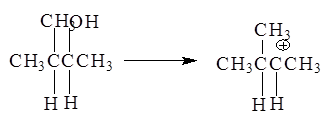
3-Метил-2-бутанол - в 2-метил-2-бутильный катион, склонный к перегруппировке в более стабильный:
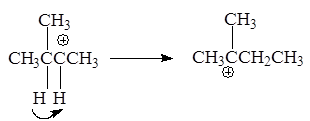
Образование последнего 2-метил-2-бутильного катиона связано с гидридным перемещением (Н-) из положения 3 в положение 2.
В перегруппировке может участвовать и алкильная группа:
