Мутации структуры белковоподобного сополимера. Компьютерное моделирование
Одно-центровые и двуцентровые интегралы естественно отнести к парам ядер (атомов), трёхцентровые интегралы- к тройкам ядер (атомов) и т. д .Тогда получаем энергию молекулы в атом-атомном приближении здесь суммирование ведётся по всем парам атомов, по всем тройкам атомов и т.д.
|
Многочастичные взаимодействия вносят малый вклад в энергию системы, и ими часто пренебрегают.
Парные взаимодействия удобно разбить на взаимодействия атомов, валентно связанных между собой, и взаимодействия атомов, валентно между собой не связанных.
Предполагается, что энергию взаимодействия можно разделить на ряд составляющих.
1. Энергия деформации связи.
При отклонении длин связей от их нормального значения возникает энергия деформация связи (Есв). Обычно связь рассматривают как гармонический осциллятор. При этом можно предположить, что при малых деформациях энергия ковалентных связей подчиняется следующей зависимости.
U(R) = K´(R-Ri)2 (2.3)
Где К – силовая постоянная,
R – равновесная длина связи
Ri – мгновенная длина связи
Рассмотрим вопрос о способе описания валентных связей. Здесь существует альтернатива[9]: 1) моделировать связи каким-либо гладким потенциалом (например гармоническим или потенциалом Морзе), 2) учитывать их как абсолютно жёсткие (геометрические) ограничения. Оба способа имеют свои преимущества и недостатки. В первом случае справедливы простые уравнения Ньютона. Однако из-за высокой "жёсткости" обычных валентных потенциалов связанные частицы могут совершать быстрые колебательные движения, учесть которые можно при очень малом шаге интегрирования. Поэтому даже после весьма большого числа шагов эволюции системы будет на самом деле прослежена лишь в течении короткого интервала времени. Проблема решается путём удаления соответствующих степеней свободы при рассмотрении химических связей как постоянных геометрических ограничений. При этом в системе действует единственный невалентный потенциал, который и задаёт минимальный временной масштаб. Однако в подобной постановке движение частиц описывается уже не уравнениями Ньютона, а уравнениями Лагранжа, что усложняет вычислительную схему и делает её более трудоёмкой. Кроме того, абсолютно жёсткие связи не вполне правильно отвечают реальной ситуации.
Оптимальный вариант состоит в подборе таких валентных потенциалов, жёсткость которых мало отличается от невалентных. Один из них, известный как потенциал FENE, имеет вид
![]() -k´r02 ln[1-(r/r0)] при r < r0
-k´r02 ln[1-(r/r0)] при r < r0
Uij(r) = (2.4)
0 при r > r0
Здесь r – расстояние между парой связанных частицi и j, а параметры k и r0 принимаются равными 10e/s2 и 1.95s. Другой удачной аппроксимацией является конструкция из двух потенциалов Леннарда-Джонса, действующих навстречу друг к другу и описывающих только отталкивание.
e0[(b/r)12 – 2(b/r)6 +1 при r < b
![]() Uij(r) = (2.5)
Uij(r) = (2.5)
 e0 b12 _ 2b6 +1 при r > b
e0 b12 _ 2b6 +1 при r > b
(2b-r)12 (2b-r)6
Здесь b – заданная длина связи между частицами i и j. Данная функция имеет нулевой минимум при r = bи становится бесконечной при r = 0 и r = 2b.
2. Энергия деформации углов.
Для каждого атома в молекуле существуют некоторые идеальные углы, отклонение от которых требуют затрат энергии угловых деформаций (Еугл). Предполагается, что эта энергия аддитивна, причём при малых отклонениях справедлив закон Гука. Аналогично энергии деформации связей можно записать.
U(q) = C´(qi - q)2 (2.6)
Где С – силовая константа,
q- идеальное значение угла связи,
qi – мгновенное значение угла связи
Деформация углов происходит значительно легче, чем деформация связей ( константа К на порядок выше, чем С).
Для описания угловых напряжений можно использовать потенциал (2.5), если в качестве параметра b взять расстояние между атомами, разделенными двумя связями.
3. Невалентные взаимодействия атомов (Ес).
|
 |
В попарно аддитивном приближении стерический вклад в потенциальную энергию молекулы выражается через взаимодействия отдельных атомов[10].
Ec = ååfij(r) (2.7)
i < j
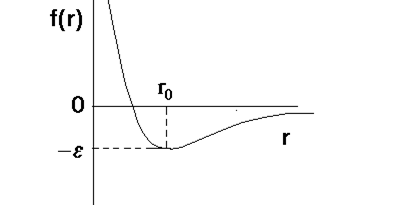
Взаимодействия валентно не связанных атомов складывается из дисперсионного (а также индукционного и ориентационного) притяжения и отталкивания, возникающего из-за перекрывания электронных оболочек на малых расстояниях. На рис. 2.1 показана потенциальная функция f(r) взаимодействия двух атомов в зависимости от расстояния rмежду ними.
Отталкивание между атомами апроксимируется обычно функциями вида B/rn или Cexp(-Dr), а притяжение – функцией A/rm(A, B, C, D, m, n – постоянные).
Отсутствие строгого выражения для f(r) вынуждает искать приближённые аналитические формы. Наибольшее распространение получили потенциалы типа "6-12" и "6 - exp".
Потенциал Леннарда – Джонса ( m – n)
f(r) = ne(n-m)-1(n/m)m/(n-m)[(s/r)n – (s/r)m] =
ne(n-m) –1[(m/n)(r0/r)n – (r0/r)m],
где r0 = 21/6´s, m и n – численные коэффициенты. Коэффициент m выбирается равным 6. Величина n лежит в интервале от 10 до 14 и чаще всего принимается равной 12.
В этом случае данный потенциал называют потенциалом "6-12". При m = 6 и n = 12 имеем
f(r) = 4e[(s/r)12 – (s/r)6] (2.8)
Для малых rфункция f(r) имеет большое положительное значение, а с ростом r – становится отрицательной, проходя при r = r0через минимум ( где f(r0) = -e) и асимптотически приближается к нулю. Значение rпри котором функция f(r) пересекает ось r , обозначено s. Наличие дальнодействующей части создаёт расчётные трудности, ибо в плотной системе для каждой частицы становится необходимым учёт её взаимодействий с большим числом окружающих частиц. Поэтому функцию 2.8. обрывают на некотором заранее выбранном расстоянии rc, полагая, что при r > rc f(r) = 0.
