Элементы теории катализа
Явление ускорения скорости химической реакции под действием веществ, непосредственно не участвующих в стехиометрическом уравнении реакции, называется катализом. Эти “сторонние” вещества, влияющие лишь на скорость реакции, называются катализа-торами. Они не смещают химическое равновесие, и с его достижением могут быть выде-лены из реакционной смеси в химически неизменном виде. Их присутствие в
равновесной системе сказывается лишь на тех термодинамических признаках системы, которые зави-сят от числа присутствующих в ней компонентов. Напомним, что в наиболее общей форме такое влияние должно учитываться через посредство активностей, связанных уравнением Гиббса-Дюгема, но в этом почти не бывает необходимости.
Классификация каталитических процессов разнообразна. Катализ бывает гомогенным и гетерогенным. Гомогенный катализ может протекать в газе и в растворе.
Гомогенный катализ
Катализ - явление разностороннее, и даже сама среда -растворитель может принци-пиально изменить механизм реакции, оказывая решающее влияние на её скорость а, значит, играть роль катализатора. Его основными видами в растворе считают катализ: кислотный, металлокомплексный, ферментный.
Внешне наиболее прост для теоретического моделирования кислотный катализ. Намного разноообразнее варианты металлокомплексного катализа. С ферментным катализом связана вся химия живых организмов. Он не имеет равных в части ускорения реакций – ферментно-катализиру-емые процессы могут ускоряться в десятки миллионов раз. Ферменты это биокатализаторы-белки.
Основные положения теории гомогенного катализа по Шпитальскому: (изложено по книге Ерёмина – научная школа МГУ):
Катализатор - вещество переводящее систему реагентов в реакционноспособное состояние путём образования с реагентами лабильного каталитического комплекса.
2) Образование комплекса - относительно быстрый квазиравновесный процесс.
3) Лабильный каталитический комплекс продукт необратимо и относительно медленно изменяется .
Общая скорость реакции пропорциональна концентрации промежуточного каталитического комплекса, но не концентрации реагента. Непосредственная пропорциональная связь между скоростью и концентрацией реагента является следствием сложного механизма процесса.
В зависимости от значения константы равновесия на стадии образования промежуточного продукта определённая доля катализатора находится в системе в свободном состоянии.
В образовании промежуточных продуктов могут одновременно принимать участие многие вещества, так что многие катализаторы, приводящие к одному общему промежуточному продукту, будут действовать как один смешанный катализатор.
Помимо катализатора в образовании промежуточных продуктов могут участвовать «сопутствующие вещества (лучше сказать частицы) », главным образом ионы H+ и OH- . (Текст в ред. Ерёмина, стр. 308).
«Сопутствующие вещества» помимо участия в образовании промежуточных продуктов могут влиять на степень лабильности промежуточного продукта, и, следовательно, на скорость его разложения даже без участия в процессе его обратимого образования.
Один и тот же катализатор может образовать с реагирующим веществом многие промежуточные продукты.
При одновременном действии многих катализаторов (пункт 6) как и при образовании многих промежуточных продуктов из одного катализатора (пункт 9) результирующая скорость реакции равна сумме скоростей реакции разложения отдельных промежуточных продуктов.
И для большей полноты см. книгу Ерёмина !!!.
Общая кинетическая схема гомогенного катализа. (см. книгу Ерёмина)
Сравнение маршрутов превращения:
![]() (11.1)
(11.1)
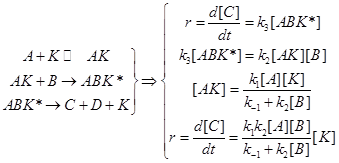 (11.2)
(11.2)
Различают два предельных случая гомогенного катализа, в зависимости от типа образующегося каталитического комплекса.
Каталитические комплексы бывают двух типов, а именно: 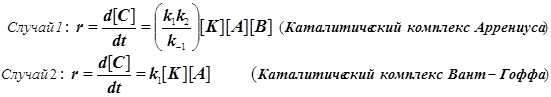 (11.3)
(11.3)
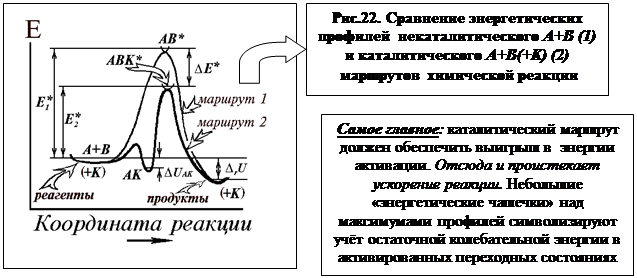
Энергетические профили некаталитического (1) и каталитического (2) маршрутов химической реакции совмещены на рисунке. Верхняя кривая отвечает некаталитическому протеканию процесса, нижняя с двумя максимумами соответствует механизму реакции в присутствие катализатора (на самом деле вдоль оси ординат обе кривые раздвинуты на величину энергии катализатора).
 |
Кислотный катализ в растворе
Имеется большое число различных механизмов кислотно-основного катализа. Некоторые из них приводят к общему катализу, а другие - к специфическому. Исчерпывающе общая классификация этого материала практически невозможна. Речь может идти лишь о каких-то достаточно общих принципах и подходах. (см. К. Лейдлер. Кинетика органических реакций, стр. 272-273).
Вначале можно рассмотреть несложный катализ в водном растворе. Реакции этого типа обычно протекают в две стадии. На первой происходит передача протона субстрату S. На второй происходит отделение протона от протонированного субстрата SH+. Присоединяющийся протон может происходить из катиона гидроксония H3O + или других кислых веществ, присутствующих в растворе; эти вещества обозначаются как BH+
Во второй стадии протон от SH+ может переходить к молекуле H2O или к любым другим основным веществам, присутствующим в растворе. Природа веществ, передающих протоны субстрату, не играет первоочередной роли в формировании кинетического закона. Однако важное значение имеют вещества, которым SH+ передаёт протон на второй стадии.
Передача протона может происходить двояко:
молекуле растворителя: SH+ + H2O = S + H3O+ . Такой механизм называется протолитическим.
Здесь может иметь место и общий, и специфический катализ в зависимости от разных причин.
молекуле растворённого вещества: SH+ + B = S + BH+. Такой механизм называется прототропным.
Здесь может иметь место лишь общий кислотный катализ .
Стандартная кинетическая схема и скорости элементарных стадий.
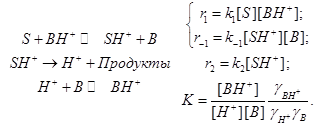 (11.4)
(11.4)
![]()
![]()
![]()
![]()
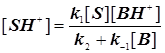
![]()
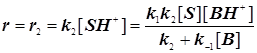
![]()
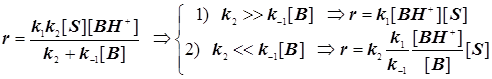 . (11.5)
. (11.5)
Случай 1: Общий кислотный катализ
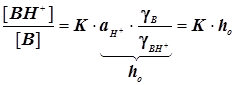 ;
; 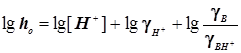
![]()
