Методы контроля и анализа веществ (химические методы)
1. (1,10) Качественная реакция на кобальт (Со)
Решение:
Кобальт можно идентифицировать, переведя его из пробы в раствор в виде ионов Co2+ по реакции
3Co + 8HNO3 (разбавленная, горячая) = 3Co(NO3)2 + 2NO↑ + 4H2O
После этого можно проводить качественные реакции на ионы Co2+.
1) Действие реагента Ильинского (1-нитрозо-2-нафтола):
В реакции Co2+ с реагентом Ил
ьинского при участии растворимого кислорода получается нерастворимое темно-красное хелатное соединение кобальта (III):
Co2+ + 12C10H6(NO)OH + O2 = 4[C10H6(NO)O]3Co↓ + 2H2O + 8H+
Строение комплексного соединения такое:
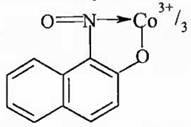
Осадок [C10H6(NO)O]3Co не растворяется в кислотах и щелочах. Идентификацию Co2+ проводят в кислой среде. Мешают ионы Cu2+, Fe3+, Fe2+.
2) Качественная реакция на ионы Co2+ с образованием кобальтонитрита (III) калия:
Нитрит калия образует с ионами Co2+ в уксуснокислом растворе при pH 4 – 5 желтый кристаллический осадок состава K3[Co(NO2)6]. Образованию осадка предшествует окисление Co2+ нитритом:
Co2+ + NO2- + 2H+ = Co3+ + NO↑ + H2O
Суммарный процесс можно показать уравнением:
Co2+ + 7NO2- + 3K+ + 2H+ = K3[Co(NO2)6]↓ + NO↑ + H2O
В разбавленных растворах осадок образуется при нагревании и отстаивании. Реакцию часто используют для отделения кобальта от мешающих ионов. Граница определения кобальта – 0,4 мкг.
2. (2,10-11) Определить нормальность раствора Ca(OH)2, титр которого составляет 0,00568 г/мл
Решение:
![]()
где ![]() – титр раствора,
– титр раствора,
![]() – нормальность раствора,
– нормальность раствора,
mэ – эквивалентная масса
Так как кислотность основания Ca(OH)2 равна 2, то
![]()
![]()
3. (2,10-11) Определить концентрацию щелочи, если на титрование 5,86 мл её раствора пошло 7,28 мл 0,56 н раствора НСl
Решение:
Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.:
![]()
![]()
4. (4,10-11) Сколько граммов PbO2 выделится на аноде при электролизе азотнокислого свинца током 0,15 А в течение 10 минут?
Решение:
По первому закону Фарадея количество вещества, выделяемого на электроде, прямо пропорционально количеству пропущенного электричества:
![]()
где ![]() – количество электричества
– количество электричества
![]() ,
,
где ![]() и
и ![]() сила тока и время соответственно,
сила тока и время соответственно,
![]() – постоянная Фарадея, 96500 Кл,
– постоянная Фарадея, 96500 Кл,
![]() .
.
![]()
![]()
5. (3-4,10) Условия съемки полярограмм в вольтамперометрии
Ответ:
Поскольку в вольтамперометрии один из электродов не поляризуется и для него потенциал остается постоянным, подаваемое на ячейку напряжение затрачивается на изменение потенциала только рабочего электрода. Если потенциал рабочего электрода измеряют относительно потенциала электрода сравнения, условно приняв последний за нуль, то в этом случае Е = Еа для рабочего микроанода и Е = - ЕК для рабочего микрокатода.
Таким образом, регистрируемая вольтамперная кривая ![]() (полярограмма) отражает электрохимический процесс, происходящий только на одном электроде.
(полярограмма) отражает электрохимический процесс, происходящий только на одном электроде.
Если в растворе присутствуют вещества, способные электрохимически восстанавливаться или окисляться (так называемые деполяризаторы), то при наложении на ячейку линейно меняющегося напряжения (скорость не превышает 200 мВ/мин) получаемая кривая ![]() имеет форму волны, в отсутствие электрохимической реакции эта зависимость линейна, как следует из закона Ома (рис. 5.1).
имеет форму волны, в отсутствие электрохимической реакции эта зависимость линейна, как следует из закона Ома (рис. 5.1).
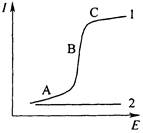
Рис. 5.1 Вольтамперная кривая в присутствии (1) и отсутствии (2) электрохимически активного соединения
При низких значениях потенциала (участок А на рис. 5.1), величина которого не достаточна для того, чтобы на рабочем микроэлектроде происходила электрохимическая реакция, через ячейку проходит очень незначительный остаточный ток, обусловленный прежде всего током заряжения двойного электрического слоя и присутствием в растворе электрохимически более активных, чем анализируемое вещество, примесей. При увеличении потенциала электрохимически активное вещество – деполяризатор вступает в электрохимическую реакцию на электроде и в результате этого ток резко возрастает (участок В). Это так называемый Фарадеевский ток. С ростом потенциала ток возрастает до некоторого предельного значения, оставаясь затем постоянным (участок С).
Предельный ток обусловлен тем, что в данной области потенциалов практически весь деполяризатор из при электродного слоя исчерпан в результате электрохимической реакции, а обеденный слой обогащается за счет диффузии деполяризатора из объема раствора. Скорость диффузии частиц деполяризатора в этих условиях контролирует скорость электрохимического процесса в целом. Такой ток называют предельным диффузионным.
Для того чтобы исключить электростатическое перемещение деполяризатора (миграцию) в поле электродов и понизить сопротивление ячейки, измерения, как было указано выше, проводят в присутствии большого избытка сильного электролита, называемого фоном. Являясь электрохимически индифферентным, вещество фонового раствора может вступать в химические реакции с определяемым веществом (часто это реакции комплексообразования). Иногда фоновый электролит играет роль буферного раствора. Например, при полярографическом определении ионов Cd2+, Zn2+, Ni2+, Со2+ в качестве фона используют аммиачный буферный раствор, который выполняет одновременно все вышеперечисленные функции.
Вольтамперная кривая описывается уравнением Гейровского-Ильковича
![]()
(знак "+" для анодного, "—" для катодного процессов),
где Е и Е1/2 — потенциал в любой точке полярографической волны и на половине ее высоты, соответственно;
