Группа пневмовирусов
Обычно для усиления контраста из состава агарового покрытия исключают феноловый красный, но это не имеет принципиального значения. Окрашивание раствором нейтрального красного проходит быстрее, однако такие препараты нестабильны и подвержены фотохимическому повреждению под действием света.
Окрашивание с помощью твердого нейтрального красного, входящего в состав агарового покрытия, происходит
медленнее, однако в тех случаях, когда необходимо выделить инфекционный вирус из индивидуальных бляшек, данный метод явно предпочтительнее.
2.3 Гемагглютинация
В культуральной жидкости инфицированных РСВ клеток гемагглютинин не обнаруживается. Гемагглютинация с эритроцитами человека, африканской зеленой мартышки, макаки-резуса, морской свинки, крысы, хомячка, мыши, гуся, овцы, свиньи, курицы и цыпленка не отмечена.
С другой стороны, ВПМ агглютинирует эритроциты мыши и хомячка. Методические аспекты постановки реакции гемаглютинации описаны в работе Компанса и др.
2.4 Гемадсорбция
Адсорбция эритроцитов на клетках, зараженных РСВ, не описана. Негативные результаты получены с эритроцитами африканской зеленой мартышки, шимпанзе, обезьяны гелады, морской свинки, крысы, хомячка, мыши, утки, гуся, голубя, курицы и цыпленка. Однако клетки, зараженные ВПМ, связывают эритроциты мыши; технические детали описаны Ком-пансом и др. .
2.5 Иммунофлуоресцентные методы
Иммунофлуоресцентное окрашивание с помощью поликлональной антисыворотки представляет собой удобный и точный метод подсчета зараженных клеток и выявления места размножения вируса при анализе фиксированных срезов зараженных тканей. Используя моноклональные антитела против индивидуальных вирусных полипептидов, иммунофлуоресцентным методом можно изучать и внутриклеточную локализацию вирусных антигенов.
Иммунофлуоресцентное окрашивание применяется также для быстрой диагностики вирусных инфекций. Это направление недавно рассмотрено в исчерпывающих обзорах, а конкретные методы обнаружения РСВ в клиническом материале описаны в работе Гарднера и др. Иммунофлуоресценция - более точный метод выявления РСВ в организме больного, чем непосредственное выделение вируса, поскольку в период реконвалесценции после вызванного РСВ заболевания зараженные клетки бывают покрыты противовирусными антителами.
Непрямая иммунофлуоресценция более чувствительна, чем прямая, однако при ее использовании возникает проблема неспецифической флуоресценции. Ее можно устранить предварительным истощением антисыворотки и антииммуноглобулинового конъюгата обработанной ацетоном культурой клеток или гомогенатом печени животных. Обработка клеток ацетоном проводится следующим образом:
1. 10s-109 клеток снимают со стекла и получают суспензию.
2. Клетки концентрируют центрифугированием и ресуспендируют в 0,01 М PBS; эту процедуру повторяют трижды.
3. Осадок клеток ресуспендируют: 5 мин в 10-кратном объеме ацетона и вновь осаждают клетки.
4. Клетки ресуспендируют в 0,01 М PBS и проводят 6 циклов осаждения для полного удаления ацетона. После этого клетки можно хранить до употребления в 0,01 М PBS при - 20 °С.
Ниже приведена стандартная методика для выявления антигенов РСВ в зараженных клетках методом непрямой иммунофлуоресценции.
1. В пластиковые чашки диаметром 50 мм помещают тщательно вымытые и дегидратированные этанолом покровные стекла и высевают по ЫО6 клеток BS-C-1. Инкубируют клетки 24 ч, промывают и заражают РСВ с множественностью инфекции около 1 БОЕ/кл.
2. После адсорбции вируса в течение 2 ч покровные стекла с зараженными клетками тщательно промывают средой MEM, содержащей 2,5% ЭТС, и инкубируют при 31 или 39 °С.
3. Через 40-48 ч после заражения клетки фиксируют на 5 мин в охлажденном до 4°С ацетоне, высушивают на воздухе 30 мин и хранят при - 20 °С.
4. Антивирусную сыворотку истощают обработанными ацетоном клетками BS-C-1 при 4°С и используют в подобранном оптимальном разведении. Кроличья сыворотка против глобулинов нескольких видов животных, конъюгированная с изотиоцианатом флуоресцеина, имеется в продаже. Конъюгат истощают обработанным ацетоном гомогенатом печени мыши или клетками BS-C-1 при 4°С.
5. Покровные стекла инкубируют с антивирусной сывороткой 1 ч при 37 °С, промывают и инкубируют еще 45 мин при 37 °С с соответствующим конъюгатом.
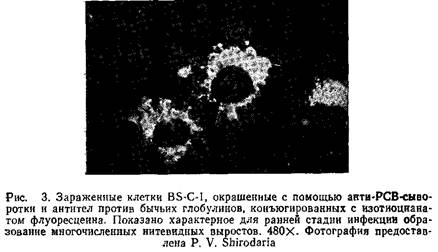
6. После промывки препараты заключают в забуференный глицерин и исследуют под флуоресцентным микроскопом. Рис.3 иллюстрирует разрешение, которое может быть получено при использовании данного метода.
Доказательствами специфичности иммунофлуоресценции могут служить:
1) отсутствие флуоресценции незараженных клеток BS-C-1;
2) отсутствие флуоресценции при использовании ЭТС вместо специфической с зараженными РСВ клетками;
3) отсутствие флуоресценции после истощения противовирусной сыворотки зараженными клетками.
Высокой чувствительностью обладает и иммунопероксидазный метод; его преимущество состоит в том, что он не требует использования микроскопа с ультрафиолетовой оптикой.
2.6 Твердофазный иммуноферментный анализ
ELISA - еще один иммунологический метод быстрого обнаружения и количественного определения РСВ. Ниже приведена типичная методика.
1. Лунки планшета для иммунологических реакций покрывают зараженными или незараженными клетками, или РСВ, очищенным центрифугированием в градиенте. Это делается одним из следующих методов:
а) клетки выращивают в лунках планшета и через ряд заражают РСВ. Когда в лунках с зараженными клетками проявляется ЦПД, клетки промывают, фиксируют раствором, содержащим этанол и уксусную кислоту, и хранят при - 20 °С;
б) в лунки планшета вносят РСВ, очищенный центрифугированием в градиенте, и высушивают в течение ночи при 37°С.
Если имеются клетки, персистентно инфицированные РСВ, их можно использовать в качестве источника антигена вместо литически инфицированных клеток.
2. Перед началом анализа все лунки планшета покрывают 5% -ным раствором БСА в PBS. В каждый опыт следует включать негативный контроль и позитивный контроль. В лунки планшета вносят образцы вируса и инкубируют в течение ночи при 4°С. Планшет промывают и добавляют овечьи антитела против иммуноглобулинов мыши, конъюгированные с пероксидазой хрена в рекомендуемом разведении. Планшет инкубируют 1 ч при 37 °С, промывают, добавляют субстрат, о-фенилендиамин, и инкубируют при 37 °С еще 30 мин. Реакцию останавливают добавлением 4,5 М H2SO4 и учитывают результаты с помощью ридера "Мультискан".
Хиерхольцер и др. описали методику, позволяющую с помощью ELISA количественно выявлять белковые полосы после электрофореза и переноса белков на нитроцеллюлозные мембраны, так называемый метод "вестерн-блотинга". Преимущество этого метода состоит в том, что он не требует использования радиоактивных изотопов.
3. Аналитические методы
3.1 Радиоактивное лечение, радиоиммуноанализ и радиоиммунопреципитация
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
