Молекулярные механизмы многообразия антител
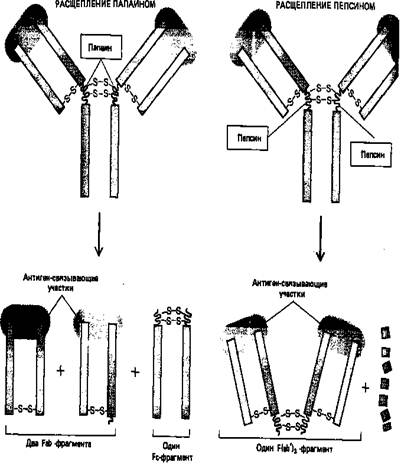
Рисунок 5. Различные фрагменты, образующиеся при расщеплении молекул антител двумя различными протеолитическими ферментами (папаином и пепсином), помогли исследователям в выяснении четырехцепочечной структуры антител.
Существует пять разных классов Н-цепей, каждый
со своими особыми биологическими свойствами
У выс
ших позвоночных существуют пять разных классов антител – IgA IgE, IgG и IgM, каждый со своим классом Н-цепей – a, b, е, g, и m соответственно. Молекулы IgA содержат a-цепи, молекулы IgG-g-цепи. Кроме того, имеется ряд подклассов IgG и некоторых других иммуноглобулинов. Разные Н-цепи придают «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса.
IgG-антитела составляют основной класс иммуноглобулинов, находящийся в крови. Они производятся в больших количествах при вторичном иммунном ответе. Fc-область молекул IgG связывается со специфическими рецепторами фагоцитирующих клеток, таких как макрофаги и полиморфноядерные лейкоциты, и в результате эти клетки могут более эффективно поглощать и разрушать внедрившиеся микроорганизмы, покрытые IgG-антителами (рис. 6).
Молекулы IgG-единственные антитела, которые могут переходить от матери к плоду. Клетки плаценты, соприкасающиеся с материнской кровью, имеют рецепторы, связывающие Fc-области молекул IgG и обеспечивающие тем самым их переход в плод. Антитела сначала поглощаются путем эндоци-тоза при участии рецепторов, а затем транспортируются через клетку и выводятся путем экзоцитоза в кровь плода. Антитела других классов не связываются с этими рецепторами и поэтому не могут проходить через плаценту.
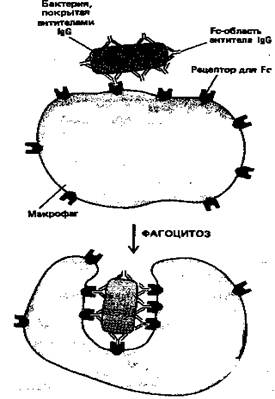
Рисунок 6. Эта схема показывает, как бактерия, покрытая антителами IgG, эффективно фагоцитируется макрофагами, имеющими на своей поверхности рецепторы, способные связывать Fc-область молекулы IgG. Связывание бактерии с этими рецепторами активирует процесс фагоцитоза.
Хотя IgG-явно преобладающий класс антител, образуемых при большинстве вторичных иммунных ответов, на ранних стадиях первичного иммунного ответа в кровь поступают главным образом антитела IgM. В секретируемой форме IgM представляет собой пентамер, состоящий из пяти четырехцепочечных единиц, так что в общей сложности IgM имеет 10 антиген-связывающих участков. Такие пентамеры даже более эффективно, чем IgG, активируют систему комплемента, когда они связываются с антигеном. Каждый пентамер содержит полипептидную цепь еще одного типа, называемую J-цепью (joining chain, ~ 20 000 дальтон). J-цепь синтезируется IgM-секретирующими клетками, ковалентно встраивается между двумя смежными Fc-областями и, по-видимому, инициирует процесс олигомеризации. IgM-это также первый класс антител, продуцируемых развивающимися В-клетками, хотя многие В-клетки со временем переключаются на выработку антител других классов. Непосредственные предшественники В-клеток, так называемые пре-В-клетки, вырабатывают μ-цепи (но не легкие цепи) и накапливают их. Позднее, когда в пре-В-клетках начинают синтезироваться и легкие цепи, они соединяются с j-цепями, образуя с ними четырехцепочечные молекулы IgM (каждая с двумя μ-цепями и двумя легкими цепями), которые встраиваются в плазматическую мембрану, где служат рецепторами для антигена. С этого момента клетки становятся В-лимфоцитами и способны реагировать на антиген. Хотя встраиваться в мембраны (в качестве антиген-специфических рецепторов) и секретироваться в водорастворимой форме могут антитела всех классов, на поверхности большинства покоящихся В-клеток находятся главным образом антитела IgM и IgD. Удивительно, что лишь очень немногие В-клетки активируются для секреции антител IgD, и у этого класса не известно никакой функции, кроме роли рецепторов для антигена.
IgA-основной класс антител в секретах (молоке, слюне, слезах, секретах дыхательных путей и кишечного тракта). Они существуют либо в виде четы-рехцепочечного мономера (подобно IgG), либо в виде димера. Молекулы IgA в составе секретов представляют собой димеры, содержащие одну J-цепь, а также дополнительную полипептидную цепь, называемую секреторным компонентом, которую димеры IgA приобретают на поверхности эпителиальных клеток, выстилающих кишечник, бронхи или протоки молочных, слюнных или слезных желез. Секреторный компонент синтезируется эпителиальными клетками и экспонируется вначале на их базальной поверхности, где служит рецептором для связывания IgA из крови. Образующиеся комплексы IgA с секреторным компонентом поглощаются путем эндоцитоза при участии рецепторов, проходят через цитоплазму эпителиальной клетки и выводятся в проток на противоположной стороне клетки. В дополнение к такой транспортной роли секреторный компонент, возможно, защищает молекулы IgA от переваривания протеолитическими ферментами секретов.
Fc-область молекул IgE связывается со специфическими рецепторными белками на поверхности тучных клеток в тканях и базофильных лейкоцитов в крови с очень высоким сродством (> 1010 литров/моль). В свою очередь связанные молекулы IgE служат рецепторами для антигена: присоединение к ним антигена приводит к секреции клетками биологически активных аминов (в частности, гистамина, а у некоторых видов – серотонина). Их защитная функция менее ясна, однако предполагается, что они делают область воспаления более доступной для лейкоцитов, антител и компонентов комплемента.
1.3 Тонкая структура антител
Уникальная особенность антител состоит в том, что они существуют в огромном числе различных вариантов: каждый класс иммуноглобулинов содержит миллионы разных антител, каждое из которых отличается от других своим антигенсвязывающим участком и аминокислотной последовательностью. Поэтому любой из таких видов антител составляет менее одной миллионной доли всех молекул иммуноглобулинов, имеющихся в крови. Этот факт поставил иммунохимиков перед чрезвычайно сложной проблемой белковой химии: каким образом можно получить достаточное количество какого-либо антитела для определения его аминокислотной последовательности и трехмерной структуры?
Проблема получения индивидуальных антител была решена благодаря специфическому свойству опухолевых клеток, образующихся при множественной миеломе – злокачественном заболевании, при котором в костном мозге развиваются множественные опухоли. Эти опухоли секретируют в кровь большие количества антител одного вида. Такие антитела гомогенны, или моноклональны, поскольку рак обычно начинается с неконтролируемого роста одной-единственной клетки; в данном случае это плазматическая клетка, секретирующая антитела. Антитело, накапливающееся в крови, называют миеломным белком.
Еще с прошлого столетия было известно, что моча больных, страдающих этим заболеванием, часто содержит необычные белки, названные белками Бене-Джонса – по имени английского врача, который их впервые описал. Однако только в 50-х годах нашего века выяснилось, что эти белки представляют собой свободные L-цепи иммуноглобулинов. Значительная часть сведений о детальной структуре антител была получена при изучении миеломных белков из мочи или крови больных или же белков от мышей, у которых были целенаправленно индуцированы аналогичные формы рака.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
