Введение в теорию атома
Полярные диаграммы функций азимута Qlm(J) и функций широты F|m|(j).
Радиальные компоненты АО атома Н и их графики. Радиальное распределение плотности вероятности и квантово-химический смысл боровского радиуса.
|
Anl | lign=top > |
AZ | ||
|
2 |
1 |
exp(-) |
(Z/a0)3/2 | |
|
1/23/2 |
2- |
exp(-) | ||
|
(½)×1/61/2 |
| |||
|
(2/81)×1/31/2 |
27-18+22 |
exp(-) | ||
|
(4/81)×1/31/2 |
6- 2 | |||
|
(4/81)×1/31/2 |
2 | |||
|
(1/192)×(¼) |
192-14423 |
exp(-4) | ||
|
(1/80)×(1/16)×(5/3)1/2 |
8023 | |||
|
(1/12)×(1/64)×1/51/2 |
1223 | |||
|
(1/768)×1/351/2 |
3 |
= Z(r/a0)
8.20.1. Квантовые числа, интервалы возможных значений.
8.20.3. Пространственные размеры атома водорода.
8.20.4. Наиболее вероятное удаление электрона от ядра.
(Радиус наибольшей плотности вероятности)
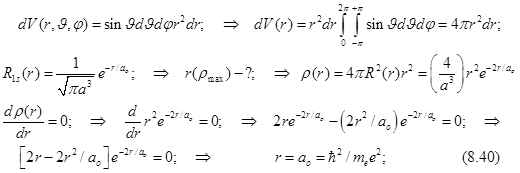
Радиус максимальной плотности вероятности называется боровским радиусом и совпадает с радиусом первой орбиты в теории атома водорода по Бору.
8.20.5.Среднее расстояние электрона от ядра.
Поскольку АО представляет собою нормированную одноэлектронную волновую функцию, то знаменатель в формуле для среднего значения любой физической величины, в том числе и расстояния электрона от ядра можно не выписывать, он равен единице, и отсюда следует:
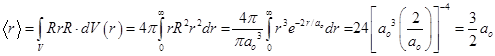 . (8.41)
. (8.41)
Среднее расстояние электрона от ядра в полтора раза больше наиболее вероятного - боровского радиуса.
Примечание. Использован вспомогательный интеграл: 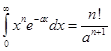
(См. теорию Эйлера Гамма - функции 1-го рода).
Энергетическая диаграмма уровней АО атома Н и Z-1–зарядного водородоподобного иона приводится ниже, где она качественные сравнивается со схемой уровней многоэлектронного атома.
