Понятие давления паров и теплоты
ДАВЛЕНИЯ ПАРОВ И ТЕПЛОТЫ ПАРООБРАЗОВАНИЯ ЧИСТЫХ ЖИДКОСТЕЙ
В этой работе описываются методы расчета и корреляции давления паров чистых жидкостей, а также энтальпий парообразования, поскольку их определение основывается на Р-Т данных.
Общие сведения по давлению паров
Согласно правилу фаз, давление паров чистой жидкости является однозначной функцией темпер
атуры насыщения, поэтому почти все данные о давлении паров представляют в виде зависимости
![]() .(7.1)
.(7.1)
Давление насыщенного пара ![]() может быть связано с любым другим интенсивным свойством насыщенной жидкости (или пара), однако температура насыщения в этом случае наиболее удобна. Если паровая фаза находится в равновесии с жидкой фазой, то условие равенства химических потенциалов, температуры и давления обеих фаз приводит к уравнению Клаузиуса-Клапейрона:
может быть связано с любым другим интенсивным свойством насыщенной жидкости (или пара), однако температура насыщения в этом случае наиболее удобна. Если паровая фаза находится в равновесии с жидкой фазой, то условие равенства химических потенциалов, температуры и давления обеих фаз приводит к уравнению Клаузиуса-Клапейрона:
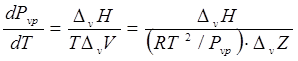 (7.2)
(7.2)
или
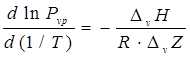 .(7.3)
.(7.3)
Большинство уравнений для расчета и корреляции давления паров получаются путем интегрирования уравнения (7.3). После интегрирования должна быть выбрана форма зависимости группы ![]() от температуры, а константа интегрирования определяется по одной точке “давление паров -температура”.
от температуры, а константа интегрирования определяется по одной точке “давление паров -температура”.
В общем случае зависимость ![]() от
от ![]() имеет S-образный вид. Для большинства веществ изменение наклона соответствует значению приведенной температуры
имеет S-образный вид. Для большинства веществ изменение наклона соответствует значению приведенной температуры ![]() =0,8-0,85. Для низкокипящих или неполярных соединений эта величина имеет более низкое значение (для метана точка перегиба
=0,8-0,85. Для низкокипящих или неполярных соединений эта величина имеет более низкое значение (для метана точка перегиба ![]() =0,7), для высококипящих, а также для полярных или ассоциированных жидкостей точка перегиба перемещается в область более высоких значений Tr (для этанола – 1,0).
=0,7), для высококипящих, а также для полярных или ассоциированных жидкостей точка перегиба перемещается в область более высоких значений Tr (для этанола – 1,0).
S-образный вид зависимости ![]() от
от ![]() обусловлен изменением отношения
обусловлен изменением отношения ![]() с температурой. Для нормальных жидкостей это отношение сравнительно нечувствительно к изменению температуры в диапазоне между нормальной температурой кипения вещества и его критической температурой. Объясняется это тем, что уменьшение теплоты парообразования компенсируется в некоторой степени уменьшением величины
с температурой. Для нормальных жидкостей это отношение сравнительно нечувствительно к изменению температуры в диапазоне между нормальной температурой кипения вещества и его критической температурой. Объясняется это тем, что уменьшение теплоты парообразования компенсируется в некоторой степени уменьшением величины ![]() . Ниже нормальной точки кипения (при
. Ниже нормальной точки кипения (при ![]() = 0,6-0,7) значение
= 0,6-0,7) значение ![]() очень близко к единице и изменение отношения
очень близко к единице и изменение отношения ![]() происходит исключительно вследствие изменения энтальпии.
происходит исключительно вследствие изменения энтальпии.
Аппроксимация Р-Т данных
Для аппроксимации экспериментальных P-T данных применяются уравнения различной сложности и теоретической аргументации. Одни из них хорошо работают при температурах ниже нормальной точки кипения, другие - при более высоких температурах. Корреляции, учитывающие S-образный вид зависимости ![]() от
от ![]() , имеют, как правило, весьма сложную алгебраическую форму. Универсальных подходов для описания ее пока не найдено.
, имеют, как правило, весьма сложную алгебраическую форму. Универсальных подходов для описания ее пока не найдено.
Выбор типа уравнения во многом зависит от объема и качества экспериментальных данных, а также от приверженности автора тем или иным подходам. Все корреляции, предложенные в настоящее время для описания P-T данных, могут быть объединены в несколько групп с весьма близкими возможностями их в каждой группе. Ниже рассмотрены методы, наиболее часто применяющиеся при массовых расчетах.
Большинство уравнений для расчета давлений паров получены интегрированием уравнения Клаузиуса-Клапейрона (7.3). Число вариантов интегрирования ограниченно. Тем не менее результаты, опубликованные в литературе, отличаются достаточно большим разнообразием. Объясняется это тем, что для достижения большей точности каждый автор обычно вводит свои поправочные коэффициенты.
В уравнении (7.3) как ![]() , так и
, так и ![]() являются функциями температуры. Величина
являются функциями температуры. Величина ![]() представляет собой изменение коэффициента сжимаемости при переходе вещества из состояния насыщенной жидкости в состояние насыщенного пара.
представляет собой изменение коэффициента сжимаемости при переходе вещества из состояния насыщенной жидкости в состояние насыщенного пара.
Для прогнозирования ![]() в настоящее время довольно широко применяется уравнение Хаггенмахера
в настоящее время довольно широко применяется уравнение Хаггенмахера
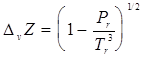 ,(7.4)
,(7.4)
где ![]() при условии, что жидкость находится под давлением, равным давлению насыщенных паров.
при условии, что жидкость находится под давлением, равным давлению насыщенных паров.
Уравнение Хаггенмахера дает хорошие результаты при температурах, близких к нормальной точке кипения, или при более низких, чем ![]() , температурах. При
, температурах. При ![]() уравнение Хаггенмахера следует использовать с осторожностью.
уравнение Хаггенмахера следует использовать с осторожностью.
Уравнение Клапейрона
При интегрировании уравнения Клаузиуса-Клапейрона в самом простом случае предполагается, что группа ![]() имеет постоянное значение, которое не зависит от температуры.
имеет постоянное значение, которое не зависит от температуры.
Обозначив постоянную величину интегрирования через “A”, получим
![]() ,(7.5)
,(7.5)
где ![]() .
.
Соотношение (7.5) иногда называют уравнением Клапейрона. Графически приведенная зависимость выражается прямой линией. Часто уравнение (7.5) оказывается неплохой аппроксимацией, но в общем случае оно дает существенные ошибки по причине того, что зависимость ![]() от
от ![]() имеет S-образный вид. Уравнение (7.5) неприменимо для температур ниже нормальной точки кипения даже для неполярных и не склонных к образованию ассоциатов веществ. Для последних линейная форма P-T зависимости может применяться для аппроксимации P-T данных только в узком температурном интервале даже в области температур, превышающих нормальную точку кипения.
имеет S-образный вид. Уравнение (7.5) неприменимо для температур ниже нормальной точки кипения даже для неполярных и не склонных к образованию ассоциатов веществ. Для последних линейная форма P-T зависимости может применяться для аппроксимации P-T данных только в узком температурном интервале даже в области температур, превышающих нормальную точку кипения.
Корреляция Антуана для давления паров
Антуан предложил широко используемую простую модификацию уравнения (7.5):
