Введение в теорию атома
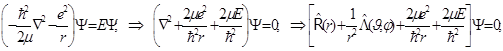
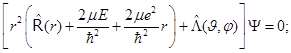 ()
()
Уравнение Шрёдингера для атома водорода приведено к компактному операторному виду, и здесь уже возможно его решение по методу Фурье разделения переменных.
Решения содержат радиальный и угловой сомножители:
![]()
8.18. Схема разделения переменных та же, что и в уравнении Лапласа (по правилу «оператор аддитивен - решение мультипликативно». Есть сомножитель радиальный, и есть угловой, и частные решения углового уравнения – сферические функции. Разделим переменные:
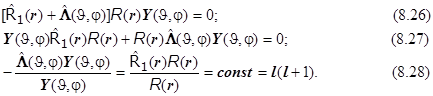
Получается система (8.29) из двух дифференциальных уравнений: (8.29.1) - уравнение Лежандра для сферических гармоник (с точностью до постоянной совпадающее с уравнением для квадрата модуля момента импульса !), и (8.29.2) - чисто радиальное:
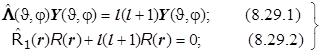 . (8.29)8.19. Итоги.
. (8.29)8.19. Итоги.
8.19.1. Гамильтониан для электрона в водородоподобном ионе (атоме):
![]() (8.30)
(8.30)
8.19.2. Лапласиан в сферических переменных:
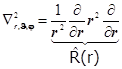 +
+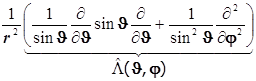
![]() . (8.31)
. (8.31)
8.19.3. Уравнение Шрёдингера ![]() с потенциальной функцией V(r) для одноэлектронных состояний:
с потенциальной функцией V(r) для одноэлектронных состояний:
![]() . (8.32)
. (8.32)
Потенциальная функция V(r) имеет вид:
1) у атома H V(r) = -e2/r,
2) у водородоподобного иона V(r) =-Ze2/r.
Уравнение Шрёдингера в общем виде для водородоподобного иона приобретает вид
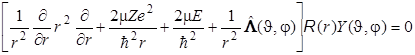 . (8.33)
. (8.33)
Оно разделяется на систему из трёх дифференциальных уравнений:
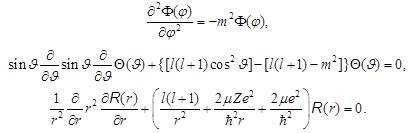 . (8.34)
. (8.34)
От потенциала зависит лишь радиальная, но не угловая часть уравнения Шрёдингера.
Система этих уравнений даёт полное описание атомных орбиталей - одноэлектронных волновых функций в простейшем случае – в водородоподобном ионе. Первое уравнение совпадает с уравнением Шрёдингера для плоского ротатора, оно описывает свойства вращения вокруг аппликаты (мы выполняли преобразования так, что это ось z). Решения этого уравнения нумеруются квантовым числом
![]() . (8.35)
. (8.35)
1) Первое уравнение (как и в плоском ротаторе) описывает компоненту момента импульса вдоль оси вращения, определяя проекцию вектора момента с помощью квантового числа m.
2) Второе и первое уравнения вместе(до разделения угловых переменных) проистекают из одного общего дифференциального уравнения Лежандра
![]() (8.36)
(8.36)
из которого следует правило квантования модуля момента импульса с помощью числа l :
![]() (8.37)
(8.37)
Уравнение (E) предписывает условие
![]() . (8.38)
. (8.38)
и возникает следствие ![]() и магнитное квантовое число m ограничено пределами
и магнитное квантовое число m ограничено пределами ![]() . Всякому квантовому числу l, таким образом, отвечает 2l+1 состояние.
. Всякому квантовому числу l, таким образом, отвечает 2l+1 состояние.
3) Радиальное уравнение приводит к квантованию энергии электронного уровня. Правило квантования одноэлектронных уровней – энергетический спектр водородоподобного иона выражается формулой Бора:
![]() или в атомных единицах:
или в атомных единицах:
![]() .
.
В итоге каждую из атомных орбиталей в атоме водорода можно быть охарактеризовать (пронумеровать) тройкой квантовых чисел ![]() . Для многих целей, связанных просто с перечислением АО, этих чисел вполне достаточно для их исчерпывающей характеристики, и, поэтому вместо символа волновой функции, достаточно просто перечислить тройку квантовых чисел индексы в скобках или в виде индексов. Этот способ записи эквивалентен волновой функции и такой же точно общий символ АО.
. Для многих целей, связанных просто с перечислением АО, этих чисел вполне достаточно для их исчерпывающей характеристики, и, поэтому вместо символа волновой функции, достаточно просто перечислить тройку квантовых чисел индексы в скобках или в виде индексов. Этот способ записи эквивалентен волновой функции и такой же точно общий символ АО.
8.20.1. Квантовые числа, интервалы возможных значений.
8.20.2. Водородоподобные атомные орбитали.
Угловые компоненты АО и распределение вероятностей.
Полярные функции азимута Qlm(J) и функций широты F|m|(j)
|
Alm(q) |
ql,m(J) |
A(j) |
F|m|(j) |
|
(1/2) ½ |
1 |
(1/2p) ½ |
1 |
|
(3/2) ½ | cosJ |
(1/2p) ½ |
1 |
|
(3/4) ½ |
sinJ |
(1/2p) ½ |
exp(±ij) |
|
(5/8) ½ |
3×cos2J-1 |
(1/2p) ½ |
1 |
|
(15/16) ½ | sin2J |
(1/2p) ½ |
exp(±ij) |
|
(15/16) ½ |
sin2J |
(1/2p) ½ |
exp(±i2j) |
|
5×cos2J -3×cosJ |
(1/2p) ½ |
1 | |
|
(5×cos2J -1)×sinJ |
(1/2p) ½ |
exp(±ij) | |
|
sin2J×cosJ |
(1/2p) ½ |
exp(±i2j) | |
|
sin3J |
(1/2p) ½ |
exp(±i3j) |
