Инструментальные методы анализа веществ
![]() .
.
Или при 25°С:
![]()
При потенциометрическом титровании часто используют титрование не до определенного потенциала, а до определенной величины рН, например, до нейтральной среды рН=7. Несколько в стороне от общепринятых методов п
отенциометрического титрования (без протекания тока через электроды), рас смотренных выше, стоят методы потенциометрического титрования при постоянном токе с поляризующимися электродами. Чаще применяют два поляризующихся электрода, но иногда пользуются и одним поляризующимся электродом.
В отличие от потенциометрического титрования с неполяризующимися электродами, при котором ток через электроды практически не протекает, в данном случае через электроды (обычно платиновые) пропускается небольшой (около нескольких микроампер) постоянный ток, получаемый от источника стабилизированного тока. В качестве источника тока может служить высоковольтный источник питания (около 45 В) с последовательно включенным относительно большим сопротивлением. Измеряемая на электродах разность потенциалов резко возрастает при приближении реакции к эквивалентной точке вследствие поляризации электродов. Величина скачка потенциала может быть гораздо больше, чем при титровании при нулевом токе с неполяризующимися электродами.
Требования к реакциям при потенциометрическом титровании – это полнота прохождения реакции; достаточно большая скорость реакции (чтобы результаты не приходилось ждать, и была возможность автоматизации); получение в реакции одного четкого продукта, а не смеси продуктов, которые при различных концентрациях могут получаться.
Примеры реакций и соответствующие им электродные системы:
Окисление-восстановление:
![]() .
.
Система электродов:
![]() .
.
В обоих случаях используется система, которая состоит из платинового электрода и хлорсеребряного.
Осаждение:
Ag+ + Cl- =AgCl↓.
Система электродов:
![]() .
.
Комплексообразование:
![]()
Система электродов:
![]() .
.
Графические способы определения конечной точки титрования. Принцип заключается в визуальном изучении полной кривой титрования. Если начертить зависимость потенциала индикаторного электрода от объема титранта, то на полученной кривой имеется максимальный наклон – т.е. максимальное значение ДE/ДV – который можно принять за точку эквивалентности. Рис. 2.1, показывающий именно такую зависимость, построен по данным табл. 2.1.
Таблица 2.1 Результаты потенциометрического титрования 3,737 ммоль хлорида 0,2314 F раствором нитрата серебра
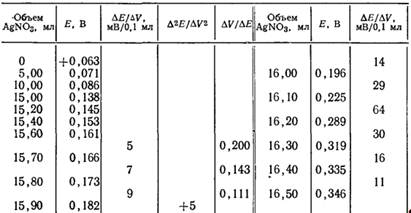
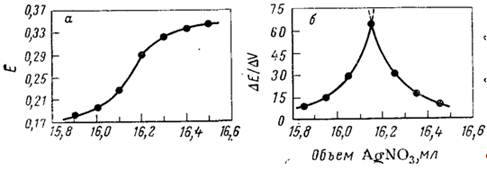
Рис. 2.1 Кривые титрования 3,737 ммоль хлорида 0,2314 F раствором нитрата серебра: а – обычная кривая титрования, показывающая область вблизи точки эквивалентности; б – дифференциальная кривая титрования (все данные из табл. 2.1)
Метод Грана. Можно построить график ДE/ДV – изменение потенциала на объем порции титранта как функцию объема титранта. Такой график, полученный из результатов титрования, приведенных в табл. 2.1, показан на рис. 2.2.
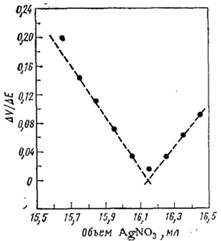
Рис. 2.2 Кривая Грана, построенная по данным потенциометрического титрования, представленным в табл. 2.1
2.2 Задача: вычислить потенциал платинового электрода в растворе сульфата железа (II), оттитрованного раствором перманганата калия на 50% и 100,1%; если концентрация ионов FeІ⁺, H⁺ и MnO₄⁻ равны 1 моль/дмі
Потенциал платинового электрода – электрода третьего рода – определяется природой сопряженной окислительно-восстановительной пары и концентрацией ее окисленной и восстановленной форм. В данном растворе имеется пара:
Fe3+ + e- ![]() Fe2+,
Fe2+,
для которой:
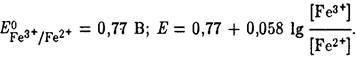
Поскольку исходный раствор оттитрован на 50%, то [Fe3+]/[Fe2+]=50/50 и 1.
Следовательно, E = 0,77 + 0,058 lg1 = 0,77 В.
3. Амперометрическое титрование
3.1 Амперометрическое титрование, его сущность, условия. Типы кривых титрования в зависимости от природы титруемого вещества и титранта на примерах конкретных реакций
Амперометрическое титрование. Для амперометрической индикации в титровании можно использовать ячейку такого же принципиального устройства, что и для прямой амперометрии. В этом случае метод называется амперометрическим титрованием с одним поляризованным электродом. В ходе титрования контролируют ток, обусловленный определяемым веществом, титрантом или продуктом реакции, при постоянном значении потенциала рабочего электрода, находящимся в области потенциалов предельного диффузионного тока.
В качестве примера рассмотрим осадительное титрование ионов Рb2+ раствором хромата калия при различных потенциалах рабочего электрода.
Области предельных диффузионных токов окислительно-восстановительных пар Pb2+/Pb и СrО42-/Сr(ОН)3 расположены таким образом, что при потенциале 0 В хромат-ион уже восстанавливается, а ион Рb2+ еще нет (этот процесс происходит лишь при более отрицательных потенциалах).
В зависимости от потенциала рабочего электрода можно получить кривые титрования различной формы.
а) Потенциал равен – 1В (рис. 3.1):
До точки эквивалентности протекающий через ячейку ток является катодным током восстановления ионов Рb2+. При добавлении титранта их концентрация уменьшается, и ток падает. После точки эквивалентности ток обусловлен восстановлением Cr(VI) до Сr(III), вследствие чего по мере добавления титранта катодный ток начинает возрастать. В точке эквивалентности (ф=1) на кривой титрования наблюдается резкий излом (на практике он бывает выражен слабее, чем на рис. 3.1).
б) Потенциал равен 0 В:
При этом потенциале ионы Рb2+ не восстанавливаются. Поэтому до точки эквивалентности наблюдается лишь небольшой постоянный остаточный ток. После точки эквивалентности в системе появляются свободные хромат-ионы, способные к восстановлению. При этом по мере добавления титранта катодный ток возрастает, как и в ходе титрования при – 1В (рис. 3.1).

Рис. 3.1 Кривые амперометрического титрования Рb2+ хромат-ионами при потенциалах рабочего электрода – 1В и 0 В
По сравнению с прямой амперометрией амперометрическое титрование, как и любой титриметрическии метод, характеризуется более высокой точностью. Однако метод амперометрического титрования более трудоемок. Наиболее широко применяются на практике методики амперометрического титрования с двумя поляризованными электродами.
Другие рефераты на тему «Химия»:
- Количественный эмиссионный спектральный анализ, его аппаратура. Пламенная фотометрия
- Модификация вторичных полимеров для изготовления изделий различного функционального назначения
- Кинетика окисления сплавов в атмосфере воздуха при высокой температуре
- Основные методы умягчения воды
- Соответствие между молекулами и группами симметрии
