Экологическое содержание темы "Основания" в курсе неорганической и органической химии средней школы
В заключение следует обратить внимание учащихся на существующую в природе связь между веществами, на их развитие от простого к сложному.
Демонстрационные опыты и практические работы по теме
Получение аминов из селедочного рассола. В селедочном рассоле содержится значительное количество аминов, преимущественно димети
ламина (СН3)2NН и триметиламина (СН3)3N.
1. В большую круглодонную колбу с отводной трубкой наливают 15–20 мл селедочного рассола, добавляют 6–7 мл концентрированного раствора едкого натра и, нагревая колбу на голом пламени, отгоняют амины в пробирку с водой, охлаждаемую снегом или льдом. Через несколько минут образуется раствор, с которым можно проделать следующие опыты, иллюстрирующие основные свойства аминов:
а) К части раствора приливают нейтральный раствор лакмуса или раствор фенолфталеина. Лакмус синеет, фенолфталеин становится малиновым. Делается вывод о том, что продукт соединения аминов с водой (рассматривать можно на примере метиламина) обладает щелочными свойствами подобно раствору аммиака:
NH3 + НОН ® NН4ОН
CH3NH2 + НОН ® СН3NH3ОН
б) К части раствора приливают раствор хлорида железа FеС13. Параллельно ставят опыт взаимодействия хлорида железа с раствором аммиака. Наблюдают образование одинаковых осадков, что подтверждает основные свойства водного раствора амина:
FеС13 + 3NH4ОН ® Fе(ОН)3 + 3NH4С1
FeС13 + 3СН3NH3ОН ® Fе(ОН)3 + 3СН3NН3С1
в) Кипятят в пробирке немного полученного раствора с добавкой щелочи и к выделяющимся парам подносят лучинку, смоченную концентрированной соляной кислотой. Образуется белый дым хлористоводородной соли амина (черный фон!).
г) Предыдущие опыты показывают большое сходство аминов с аммиаком. Для установления отличия их от аммиака и принадлежности к органическим соединениям демонстрируют горючесть аминов. Кипятят раствор амина и поджигают пары его у отверстия пробирки.
Последние два опыта получаются лишь в том случае, если, пользуясь селедочным рассолом, удается получить не слишком слабый раствор аминов.
2. Нагревают в колбе смесь селедочного рассола со щелочью, как было указано выше. К отводной трубке колбы подносят влажную лакмусовую бумажку; бумажка синеет. Подносят стеклянную палочку, смоченную концентрированной НС1, образуется белое облачко хлористоводородных солей аминов. Поджигают пары аминов у отводной трубки, они горят бледным пламенем. Пропускают пары в раствор хлорида железа, образуется осадок гидроокиси железа.
Получение метиламина из хлористоводородной соли и опыты с ним
Предварительно учащиеся знакомятся с запахом метиламина. Для этого в пробирке или на стекле к небольшой щепотке хлористоводородного метиламина они прибавляют 5–7 капель концентрированного раствора щелочи. Отмечают сходство запаха выделяющегося метиламина с запахом аммиака.
Для демонстрации опытов с метиламином в небольшую колбочку с отводной трубкой и капельной воронкой помещают 2–3 г. соли, в капельную воронку наливают концентрированный раствор щелочи. Метиламин получают, прибавляя понемногу из воронки щелочь к взятой соли. С метиламином проделывают следующие опыты:
а) Пропускают выделяющийся газ в воду, подкрашенную фиолетовым или красным лакмусом. Лакмус синеет. Делают заключение о том, что не только по запаху метиламин имеет сходство с аммиаком, но и по химическим свойствам (щелочные свойства водного раствора). Составляется уравнение гидратации метиламина.
б) Получают снова раствор метиламина, пропуская газ в воду (без лакмуса), и проводят реакцию с раствором хлорида железа, как было указано выше (пункт «б»). Подтверждаются щелочные свойства гидроокиси мети-ламмония.
в) К отводной трубке колбы подносят открытую склянку с концентрированной соляной кислотой или палочку, смоченную кислотой. Образуется густое облако дыма хлористоводородной соли (черный фон!). Параллельно ставят опыт с аммиаком. Составляют уравнение реакции солеобразования и, проводя далее аналогию с аммиаком и солями аммония, объясняют реакцию получения амина из соли (см. выше).
г) Чтобы показать отличие метиламина от аммиака, демонстрируют горючесть метиламина, поджигая газ у отводной трубки колбы. Учащиеся знают, что аммиак на воздухе не горит. Для большей убедительности над пламенем горящего метиламина помещают стакан, сполоснутый известковой или баритовой водой. Появление мути на стенках свидетельствует о наличии углерода в горящем веществе (чего нет в аммиаке) и о принадлежности его к органическим соединениям.
Получение метиламина из ацетамида. Для получения метиламина и постановки опытов с ним можно воспользоваться реакцией амида уксусной кислоты с хлорной известью:
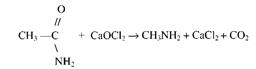
В маленькую колбочку с отводной трубкой помещают около 3 г ацетамида и двойное количество смеси хлорной извести с гидроокисью кальция, замешанной на воде. Вещества перемешивают и нагревают. Выделяется газообразный метиламин. С ним проводят опыты, как указано выше (растворение в воде, окраска лакмуса, горение и т.д.). Уравнение реакции образования метиламина с учащимися не разбирается.
Ацетамид, необходимый для опытов, может быть синтезирован учащимися в химическом кружке.
Получение ацетамида. Ацетамид может быть получен взаимодействием карбоната аммония и уксусной кислоты:
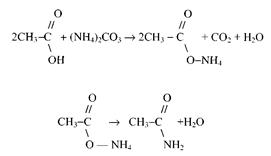
В круглодонную колбу наливают 15 г. уксусной кислоты и прибавляю: небольшими порциями 8 г карбоната аммония (выделение СО2). Колбу закрывают пробкой с вертикальным воздушным холодильником и нагревают около часа до слабого кипения. Затем содержимое переливают в колбу для перегонки, закрывают колбу пробкой с термометром, присоединяют небольшой нисходящий воздушный холодильник и медленно производят перегонку, пока температура не поднимется до 160° С. При этой температуре удаляют холодильник и отводную трубку колбы помещают непосредственно в приемник. Продолжают перегонку до 200° С. Затем меняют приемник и после этого отгоняют ацетамид в интервале температур 200–220° С. Полученный продукт без очистки можно применять для получения метиламина. Ввиду гигроскопичности ацетамид нельзя держать на открытом воздухе.
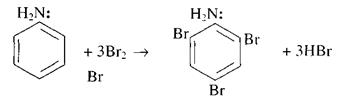
Анилин
Опыты с анилином должны показать, что это вещество принадлежит к классу аминов, имеет свойства основания и в то же время отличается от алифатических (жирных) аминов по степени проявления основных свойств. Большое внимание также должно быть уделено получению анилина из нитробензола ввиду особого исторического значения этой реакции и ее роли в современной промышленности. Ввиду ядовитости паров анилина опыты следует проводить в вытяжном шкафу.
Отношение анилина к индикаторам. К 100 мл воды в демонстрационном стакане прибавляют 1 мл анилина и взбалтывают смесь стеклянной палочкой. Половину раствора отливают в другой такой же бокал. После этого к одной половине раствора приливают раствор фенолфталеина, к другой – фиолетовый раствор лакмуса. Окраска индикаторов не изменяется.
Другие рефераты на тему «Педагогика»:
- Формирование орфографических умений младших школьников на уроках русского языка в процессе обучения правописанию
- Методика реализации межпредметных и внутрипредметных связей при обучении математике
- Экспериментальное исследование взаимодействия детского сада и семьи в физическом воспитании и развитии детей дошкольного возраста
- Оформление письменных работ
- Элективный курс по математике для классов спортивно-оборонного профиля
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
