Экологическое содержание темы "Основания" в курсе неорганической и органической химии средней школы
Взаимодействие анилина с кислотами. После того как показано, что анилин не действует на индикаторы, т.е. не обладает щелочными свойствами, возникает вопрос о том, обладает ли вообще он свойствами оснований, вступает ли он, например, в реакции солеобразования с кислотами.
1. В пробирку с 5 мл воды учащиеся наливают около 0,3 мл анилина. Смесь взбалтывают. Убеждаются, что анилин почти не раст
ворился в воде. Добавляют по каплям концентрированную соляную кислоту. Анилин растворяется. Составляют уравнение реакции образования хлористоводородного анилина.
К раствору соли анилина добавляют по каплям концентрированный раствор щелочи. Снова выделяется анилин в виде маслянистой жидкости. Составляют уравнение реакции.
При проведении опыта следует пользоваться концентрированными растворами кислоты и щелочи с той целью, чтобы не вводить большого количества воды, иначе из-за частичной растворимости анилина (1 г анилина растворяется в 30 мл воды) выделение его будет мало заметно.
2. В демонстрационную пробирку наливают 5 мл анилина и затем примерно такой же объем концентрированной соляной кислоты или 50-процентной серной кислоты. Дают некоторым учащимся убедиться, что проходит экзотермическая реакция. Охлаждают пробирку в струе холодной воды. Выделяются кристаллы соли. Растворяют соль по возможности в небольшом количестве воды (воду добавляют небольшими порциями и пробирку встряхивают). Если остался непрореагировавший анилин, отфильтровывают от него раствор, а к раствору соли добавляют концентрированный раствор щелочи. Выделяется свободный анилин.
Тем или другим из этих опытов устанавливается, что анилин является основанием; отсутствие же действия его на индикаторы говорит о том, что он основание более слабое, чем жирные амины.
Так как по составу молекул жирные амины и анилин отличаются тем, что вместо предельного радикала здесь имеется бензольное ядро, то, очевидно, что ослабление основных свойств аминогруппы обусловлено влиянием ароматического радикала – С6Н5.
Взаимодействие анилина с бромной водой. Как известно, влияние атомов друг на друга в молекуле взаимно. Если бензольное кольцо влияет на аминогруппу в анилине, ослабляя проявление ею свойств основания, то можно ожидать, что и бензольное ядро под влиянием этой группы будет обладать свойствами, отличными от свойств бензола. С подобным изменением свойств ядра учащиеся уже встречались на примере фенола.
Встает вопрос, не ослабляет ли аминогруппа связь атомов водорода с ядром, подобно тому как эту связь ослабляет гидроксильная группа в феноле, и не будет ли анилин реагировать с бромной водой, как реагирует с ней фенол.
1. В колбе или демонстрационной пробирке растворяют при встряхивании в 10 мл воды 1 мл анилина. К полученному раствору (эмульсии) добавляют бромную воду до образования белого осадка.
Осадок представляет собой триброманилин:
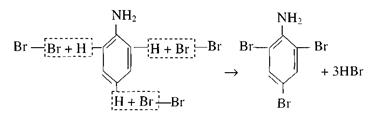
Необходимо, чтобы растворы анилина и брома были достаточно концентрированными. Вместо раствора анилина можно воспользоваться раствором его соли.
Окисление анилина. Анилин сравнительно легко окисляется в разнообразные продукты. При окислении анилина хромовой смесью и некоторыми другими окислителями образуется так называемый черный анилин, применяемый для окраски в черный цвет тканей, дерева кожи.
1. В демонстрационной пробирке к 3–4 мл водной эмульсии анилина приливают 10–12 мл хромовой смеси. Жидкость взбалтывают и подогревают. Вначале она приобретает зеленую окраску, затем синеет, при дальнейшем нагревании образуется осадок черного анилина. Характер осадка выявляется при сильном взбалтывании смеси в пробирке.
2. В 100 мл воды растворяют 2 г бихромата калия К2Сr2О7 и 1 мл концентрированной серной кислоты. К полученному раствору добавляют 2 г солянокислого анилина или по 1 мл анилина и концентрированной соляной кислоты. Смесь перемешивают стеклянной палочкой. В образующийся раствор быстро вносят кусок хлопчатобумажной ткани. Краситель с тканью нагревают, затем ткань достают, отжимают валиком на гладкой поверхности и развешивают на стеклянных палочках.
3. Готовят раствор солянокислого анилина, приливая к 50 мл воды 2 мл анилина и 3 мл концентрированной соляной кислоты. К раствору добавляют еще 1 г хлорида аммония. Полученный раствор наносят кисточкой на гладкую поверхность доски.
После того как раствор впитается, таким же способом покрывают дерево вторым раствором, приготовляемым растворением 4 л бертолетовой соли и 6 г медного купороса в 50 мл воды. Бертолетова соль окисляет анилин, и поверхность доски постепенно принимает черную окраску. Хлористый аммоний и медный купорос способствуют ускорению процесса окисления и получению плотной и прочной окраски. После высыхания поверхности на нее еще несколько раз наносят попеременно первый и второй растворы.
Реакция анилина с хлорной известью. При взаимодействии анилина с хлорной известью даже при очень сильных разбавлениям образуется характерное фиолетовое окрашивание. Хлорная известь поэтому может служить реактивом на анилин.
В цилиндр или стакан наливают 200–300 мл воды, растворяют в ней несколько капель анилина и приливают очень немного свежеприготовленного и профильтрованного водного раствора хлорной извести. Образуется фиолетовое окрашивание (белый фон!). Если раствор анилина взят слишком концентрированный, опыт проходит менее наглядно, так как окраска образуется слишком темная. В таком случае смесь растворов следует разбавить водой. Химизм этой реакции с учащимися не рассматривается.
Получение анилина. Современное производство анилина основано на реакции восстановления нитробензола, открытой Н.Н. Зининым.
В промышленном способе производства для восстановления нитробензола используются соляная кислота и железные или чугунные опилки. Все эти вещества загружаются в реактор; образующийся водород в наиболее активной своей форме – «в момент выделения» – энергично восстанавливает нитробензол в анилин.
В школьных опытах получения анилина для ускорения реакции вместо железа используют обычно олово или цинк. Опыт с железом может быть перенесен на практические занятия или в химический кружок и поставлен там не только для иллюстрации основной химической реакции, но и с целью отражения важнейших производственных операций.
1. В колбочку емкостью 100 мл вносят 2–3 капли нитробензола, приливают 1–2 мл концентрированной соляной кислоты и вносят 2–3 маленьких кусочка цинка (или олова). Если реакция пойдет слишком бурно, колбочку охлаждают в струе холодной воды или в стакане с водой. Когда запах нитробензола исчезнет или почти исчезнет, в колбу приливают концентрированный раствор щелочи (30–40-процентной) до тех пор, пока образующийся вначале осадок гидроокиси цинка Zn(ОН)2 ввиду своей амфотерности не растворится при дальнейшем прибавлении щелочи:
Zn(ОН)2 + 2NаОН ® Na2ZnО2 + 2Н2О
Это будет гарантией того, что щелочь выделит анилин из хлористоводородной соли. Чтобы констатировать образование анилина, присоединяют к колбе холодильную трубку и отгоняют около 0,5–1 мл жидкости. Анилин гошпся вместе с парами воды в виде белой эмульсии. Разбавляют дистиллят водой, чтобы анилин растворился, и открывают его с помощью раствора хлорной извести. Одновременно убеждаются, что нитробензол не дает окрашивания хлорной известью.
Другие рефераты на тему «Педагогика»:
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
