Способы реализации приёма системности и систематичности на уроках химии
Методические рекомендации по использованию опорного конспекта на уроке новых знаний по теме: «Соединения и свойства железа»
О.П. Чиркова
Средняя школа №1 с. Хмелевка, Заринский район
Цели урока:
Образовательная: дать учащимся конкретные представления о свойствах металлов, относящихся к побочным подгруппам, и о связи этих свойств со строением атомов; познакомить с химией металл
ов, проявляющих разную степень окисления.
Воспитательная: воспитывать диалектико-материалистическое мировоззрение.
Развивающая: продолжить развитие мыслительных способностей.
Оборудование: Fe, HCl (разб.), (конц.), H2SO4(конц.), NaOH, FeCl3, FeSO4, пробирки, штативы, модели кристаллических решеток.
Тип урока: урок новых знаний.
Ход урока
I. Тема, цель, мотивация учебной деятельности.
II. Изучение нового материала.
План
Строение атома железа, физические свойства, аллотропия железа.
В чем состоит особенность строения атомов элементов, находящихся в побочных подгруппах?
Задание: Составьте схему строения атома железа.
Какие степени окисления может проявлять железо? (2-3)
Объяснение: железо существует в двух аллотропных модификациях (видоизменениях). α-железо кристаллизуется в виде кубической объемоцентрированной кристаллической решетки, а γ-железо в виде кубических гранецентрированных кристаллов.
Скажите, какая из них более плотно упакована? (гранецентрированная).
Отсюда понятно, почему при переходе из α-железа в γ-железо, железо уменьшает свой объем. Этот переход осуществляется при 910°С. γ-железо не магнитно. (Использование в практике).
Какие вам известны физические свойства железа?
Ρ=7,87, Тпл.=1539°С.
Слушаем историческую справку по использованию железа.
Химические свойства железа.
Исходя из строения атома, давайте предположим, в какие химические реакции будет вступать железо? (Учащиеся записывают в тетради и на доске)
2Fe + 3Cl2 = 2FeCl3 (сильн. окисл.)
Fe + S = FeS (слабые окислит.)
Показывается ржавый гвоздь и спрашивается, что произошло с ним?
Учащиеся:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Выделяется особенность взаимодействия с О2.
3Fe + 2O2 =Fe3O4 (FeO·Fe2O3)
Так как железо может быть двух и трехвалентным, то оно дает два рода соединений:
FeO Fe 2O3
Fe(OH)2 Fe(OH)3
FeCl2 FeCl3
Итак, мы установили ряд свойств железа. Давайте представим атом железа в виде «жука- паучка» (опорной схемы):
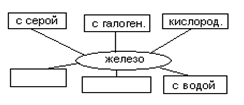
Сейчас вы будете выполнять лабораторную работу, то или опровергните, или подтвердите мое предположение.
Выполнение лабораторной работы.
Обсуждение и достраивание опорной схемы.
Итог урока. Д/З.
Методические рекомендации по использованию опорно-логической схемы на уроке новых знаний и на уроке закрепления и совершенствования новых знаний по теме: «Простые и сложные вещества»
Другие рефераты на тему «Педагогика»:
- Зарубежные педагогические системы на примере Японии
- Музыка и ее место в системе дворянского образования в XIX веке в России
- Внеклассное мероприятие профилактической направленности "В ХХІ век - без вредных привычек"
- Формирование лексики у дошкольников с общим недоразвитием речи
- Возрастные особенности внимания
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
