Способы реализации приёма системности и систематичности на уроках химии
Особое место в технологии концентрированного обучения занимает лекционная подача укрупненного материала при помощи концепта. Она имеет разные формы, но мы выделим две из них, получившие наибольшее распространение в практике нашей школы: 1) объяснение по готовому концепту с применением лекционного «изложения по спирали» (термин С.Д. Месяца); 2) эвристическое постижение нового материала с появляю
щимся (или заполняющимся) концептом или так называемый сократический урок с элементами метода проектов.
Новый материал учитель излагает на уроке как обычно: максимально использует демонстрационный эксперимент, технические средства обучения, аудиовизуальные средства. В зависимости от содержания материала, состава учащихся, задач, решаемых уроком, учитель сам выбирает форму работы: лекцию, беседу, эвристическую беседу или другую форму первичного предъявления нового материала. Но здесь есть и особенности: во-первых, лекцию, рассказ, беседу следует строить в соответствии с планом расположения материала в опорном конспекте и его содержанием. Поэтому учитель должен в своем рассказе осветить весь материал опорного конспекта. Однако по содержанию рассказ учителя может быть шире и глубже. В конспекте же, который в конце урока получит каждый ученик, следует включать только тот материал, который должен быть понят и усвоен учеником. Во-вторых, во время объяснения учителя ученик не должен вести записей. Он слушает учителя, отвечает на его вопросы, думает, разбирается в материале, но никаких записей не делает. Это раскрепощает ученика. Слушать и одновременно вести записи умеют только самые сильные учащиеся. Большинство ребят, записывая что-то за учителем, теряют нить рассуждений, пропускают отдельные важные моменты и не получают поэтому единой целостной картины. Целесообразнее будет давать в конце урока (иногда в начале урока) каждому ученику поурочную карточку. В ней есть опорный конспект, в котором в свернутом виде изложена вся информация, выданная учителем.
После объяснения материала всему классу показывается крупно написанный опорный конспект. Он может быть изображен цветными мелками на доске и предварительно закрыт шторкой; записан на оборотной стороне поворачивающейся доски; выполнен на кодоленте цветными фломастерами или на отдельном большом плакате. Учитель вторично быстро и четко, используя рисунки на опорном конспекте, повторяет весь ранее изложенный материал. Это обычно продолжается 2-3 минуты при максимальном внимании класса. Ученик при такой форме закрепления видит наглядно весь материал, изложенный учителем. Он может связать непонимание отдельных моментов с конкретным словом, рисунком и тут же или на следующем уроке спросить у учителя. Ему сразу видно, что он должен запомнить по данной теме. Главное в процессе изложения нового материала ─ добиться, чтобы каждый ученик разобрался в каждой части конспекта, чтобы не оставалось «темных пятен». Над этим учитель работает и на последующих уроках. Так как, если ученик не учит материал, а зубрит конспект, то на следующем уроке, воспроизводя конспект, он сделает массу смысловых ошибок, особенно в рисунках. Именно поэтому следует добиваться понимания материала каждым учеником.
Но важно, чтобы использование опорных схем не исключало развития речи учащихся. Поэтому В.Ф. Шаталов вводит самоконтроль, подобный тому, что при групповом обучении осуществляется в парах. Чтобы учитель мог услышать речь каждого, ученику предлагается наговаривать свой ответ на магнитофон. А вот учет работы каждого ученика у В.Ф. Шаталова тоже осуществляется при помощи экрана успеваемости.
Методические рекомендации по использованию опорного конспекта на уроке-зачете по теме: «Водород, кислоты, соли»
О.П. Чиркова
Средняя школа №1 с. Хмелевка, Заринский район
Вместо традиционного урока обобщения знаний по теме «Водород. Кислоты. Соли» (VIII класс) Ольга Павловна провела открытый урок-зачет в виде пьесы.
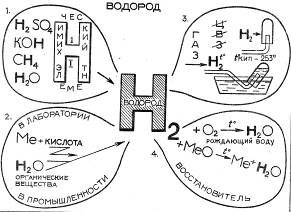
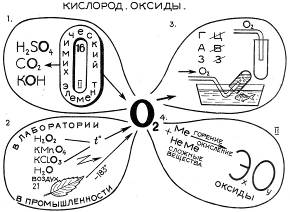
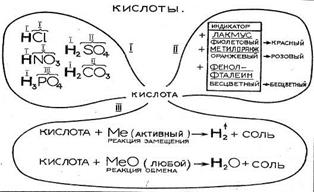
Для фронтальной проверки знаний был выбран программированный контроль (графический диктант на два варианта), устная беседа, химическая разминка. Для индивидуальной ─ защита опорных конспектов «Водород», «Кислород» методом сравнения, защита опорного конспекта «Кислоты» на всех этапах урока, химический эксперимент, цифровые диктанты, химический ринг, скоростная химическая дорожка (для проверки усвоения подтемы «Соли»).
Цели урока: Проверить степень усвоенности материала. Выявить пробелы в знаниях.
|
Этапы урока; Время, мин |
Ход урока |
|
I. (1-2 мин). |
Организационный момент. Приветствие. Цели урока. Ведущий. Урок подготовлен в виде пьесы в четырех действиях. Действующие лица и исполнители: Обыватели-дилетанты ─ учащиеся, сидящие на третьем ряду в классе. Главные оппоненты ─ учащиеся, сидящие на втором ряду в классе. Хранители знаний ─ учащиеся, сидящие на первом ряду в классе. Ведущий ─ учитель химии. |
|
II. |
Действие 1. На скамейках в кабинете химии слева сидят обыватели-дилетанты и ведут незатейливый разговор. Первый. Вы слышали? В городе Кислород появился. Важный такой. Идет – под ногами ничего не видит, ни на кого не смотрит. Второй. Как же, как же! Загордился! Было бы от чего. Он, оказывается, газ и, видите ли, только от него зависит жизнь на Земле! Третий. Ой, не говорите. На днях гуляю, а навстречу ─ кто вы думаете? ─ Водород! Не идет, а прямо-таки летит. Спрашиваю: «Ты куда?» ─ «Кислород ищу». ─ «Зачем он тебе?» И что, вы думаете, он мне ответил? На гремучее дело хочет его подбить, представляете?! (Тихо, подчти шепотом). Так и сказал: «Гремучую смесь сделаем». Ой, что будет, что будет! А потом, говорит, может, повезет и он оксид металла встретит. Зачем-то он ему тоже нужен. Ведущий О чем идет разговор? Какие свойства остались без внимания? Необходимо защитить знания о свойствах водорода (к доске приглашаются два человека для защиты опорных конспектов «Водород», «Кислород»).
|
|
| |
|
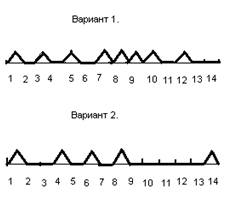
Фронтальная (письменная) проверка знаний ─ графический диктант. Вариант 1. O2 Вариант 2. H2. Условные обозначения: «─» ─ да, «^» ─ нет. 1.Хорошо растворяется в воде. 2. Плохо растворяется в воде.3. Легкий газ. 4. Тяжелый газ. 5. Горючий газ. 6. Газ, поддерживающий горение. 7. Восстановитель. 8. При смешении с кислородом взрывается при обычных условиях. 9. Горит спокойно. 10. Взаимодействует с оксидом алюминия. 11. Собирают методом вытеснения воздуха. 12. Собирают в опрокинутый вверх дном сосуд. 13. Собирают под водой. 14. Собирают в прямостоящий сосуд. Ответы. | |
|
| |
|
Работа с учебником. В тексте (с. 66) «Применение водорода» выделить главное (ведущий обращает внимание на необходимость защиты окружающей среды). Ведущий. А как получают водород H2? | |
|
III |
Действие 2. Дилетанты-обыватели. Придумали в школе изучать кислоты! К ним и прикасаться страшно, того и гляди, съедят не только мертвую, но и живую ткань! Б-р-р… Ведущий.1.А что это за вещества ─кислоты? 2. Какие вы кислоты знаете? (Вызывает учащегося для защиты 1-й части опорного конспекта «Кислоты» К доске одновременно выходят два ученика: один теоретически защищает 2-ю часть конспекта «Кислоты», второй практически распознает кислоту, выполняя экспериментальное задание: «В трех пронумерованных склянках налиты три бесцветные жидкости. Определите, в какой склянке находится кислота»). Ведущий.Какие еще два химических свойства кислот мы изучили? (Защита 3-й части конспекта.) Ведущий. Назовите номера практически возможных реакций. Обоснуйте правильность ответа: 1.Al +HCl→ 2.Cu + H2SO4→ 3.CuO + H2SO4→ 4.Ag + H3PO4→ 5.Al2O3 + H2SO4→ 6.Fe2O3 + HCl→ 7. P2O5 + HNO3→ (К доске приглашают одного ученика для выполнения задания.) «Даны: Mg, HCl, MgO, Cu, CuO.1. Составьте прогноз возможных реакций. 2. Напишите уравнения возможных реакций, укажите условия их течения». Ведущий. Что за вещества образовались в результате взаимодействия Mg, MgO, CuO с соляной кислотой?
|
|
Действие 3. Беседу с классом проводят дилетанты-обыватели. Первый. Ты знаешь соль? Второй. Знаю. Первый. А какая она? Второй. Белая, крупинками, а самое главное ─ соленая. Третий. Её еще в пищу добавляют. Первый. Я не понимаю. Так она что ─ одна? Второй. Конечно, одна-разъединственная. Первый. А почему они говорят о солях? Значит их много? | |
|
IV |
Фронтальная беседа. Сколько же известно солей? Каков состав солей? Из перечня веществ назовите только формулы солей: 1)CaO. 2)Ca(NO3)2. 3) Ca(OH)2. 4) FeCl2. 5) HCl. 6) H2O. 7) ZnS. 8) H2SO4. 9) CuSO4. 10) Mg3(PO4)2. 11) HgCl2. 12) K2CO3. Представители еще каких классов веществ есть в задании? Назовите оксиды, кислоты. Какое вещество по составу мы не можем отнести ни к одному известному нам классу веществ? (Ca(OH)2, будем изучать его в дальнейшем). Как дают название соли? Как составить формулу соли? Химическая разминка: учащиеся составляют формулы солей и дают им названия. Для этого учитель показывает сигнальные карточки: Na; K; Li; Ca; Ba; Zn; Mg; Fe; Cu; Pb; Hg; ═SO4; ═S; ═SO3; ─NO3; ≡PO4; ═CO3; ─Cl. Химический ринг (проверяется умение называть и составлять формулы солей). На столе у хранителей знаний - волчок со стрелкой и металлическим шариком, рядом ─ карточки с номерами с 1 по 36 в соответствии с цифровым полем игры; на обратной стороне карточки ─ название соли (задание: составить формулы) или формула (задание: дать название соли). Ведущий обращает внимание учащихся на три «скоростные химические дорожки» (записаны на доске): NaCl; K2CO3; Ba(NO3)2; MgCl2; Li3PO4; CuCl2. Na2CO3; KCl; Mg(NO3)2; Na2SiO3; ZnS; ZnSO4. CuSO4; Ca(NO3)2; FeCl3; K2SO3; Na2CO3; K3PO4. Желающие выполнить задание получают карточки (в соответствии с содержанием одной из химических дорожек). Они должны дать название соли, сопровождая этим каждый шаг. |
|
V |
Действие 4. Итог урока. Слово хранителям знаний. Подведение итогов урока, награждение. |
Другие рефераты на тему «Педагогика»:
- Разработка методического обеспечения лабораторного практикума по биофизике
- Математика в детском саду
- Специфические особенности и роль лингвострановедческого материала в процессе обучения чтению на уроках английского языка в 7-х классах
- Методика реализации межпредметных и внутрипредметных связей при обучении математике
- Влияние средств массовой информации на формирование личности детей и подростков
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения