Термодинамика необратимых процессов и проблем экологии
Физику дальше ставят как будто совсем неразрешимый вопрос: в каком из шаров находятся все молекулы газа? На вопрос, где находится одна выбранная молекула, физик не мог ответить. Где же ему ответить на второй вопрос?! Ведь при О °С и 1 атм в 1 см3 газа находится 2,7x1019 молекул. [Для сопоставления: пять миллиардов лет (возраст Земли) - 1,6х1017 секунд.] Физик, однако, с полной уверенностью отве
тит: ни в одном из шаров не содержатся все молекулы газа. Молекулы газа равномерно распределены между обоими шарами. Во всяком случае, отклонение от равномерного распределения при значительном объеме шаров, значит, и при большом числе молекул крайне мало, и этим отклонением можно спокойно пренебречь.
Откуда такая уверенность? Из подсчета вероятностей. Именно потому, что для каждой молекулы вероятность находиться в том или другом шаре равна половине, все молекулы не могут находиться в одном только шаре. Вероятность такого случая тем меньше, чем больше число молекул. При том числе молекул, с каким обычно имеют дело в термодинамике, вероятность скопления всех молекул в одном только шаре чрезвычайно мала. Выдающийся французский математик Э. Борель (1871-1956) писал: "Я пришел к выводу, что не следует бояться применить слово достоверность для обозначения вероятности, которая отличается от единицы на достаточно малую величину". Статистический закон для большого числа молекул пробил себе дорогу через случайности для отдельной молекулы.
Приведенный пример свидетельствует, что существует связь между возрастанием энтропии в опыте Гей-Люссака и вероятностью распределения газа между обоими шарами. Обобщая, можно сказать: при самопроизвольном процессе система переходит из менее вероятного состояния в более вероятное.
4. Энтропия и приведенная теплота
Первое начало термодинамики позволяет определить, возможен ли с энергетической точки зрения тот или иной процесс в замкнутой системе. Но оно ничего не говорит о возможных направлениях процессов (в частности самопроизвольных). Так, например, первый закон не запрещает самопроизвольного перехода теплоты от холодного тела к горячему, либо концентрирования газа в малой части сосуда и снижения давления в остальной части сосуда. Но, как известно, в природе такие процессы не наблюдаются.
Для суждения о возможном направлении процессов в термодинамике вводится еще одна функция состояния - энтропия.
Так как энтропия является функцией состояния макросистемы, то внутренняя энергия может рассматриваться как функция энтропии и, в простейшем случае, одного внешнего параметра, например V.
Тогда
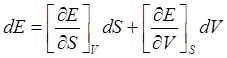 (2)
(2)
При равновесных процессах 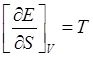 . С другой стороны, первое начало термодинамики утверждает, что
. С другой стороны, первое начало термодинамики утверждает, что
![]() (3)
(3)
Сравнивая выражения (2) и (3), нетрудно установить тождественность этих соотношений при условии выполнения равенств:
![]() (4)
(4)
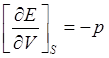 (5)
(5)
Из равенства (4) видно, что для обратимых процессов
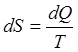 (6)
(6)
Так как dS является полным дифференциалом, то и величина ![]() также есть полный дифференциал, т.е. множитель
также есть полный дифференциал, т.е. множитель ![]() является для количества теплоты dQ нормирующим. Величина
является для количества теплоты dQ нормирующим. Величина ![]() называется приведенной теплотой, ее значение можно определить экспериментально, что имеет большое практическое значение.
называется приведенной теплотой, ее значение можно определить экспериментально, что имеет большое практическое значение.
Зная элементарное изменение энтропии dS, можно без труда найти и конечное изменение этой величины для любого обратимого процесса. Именно:
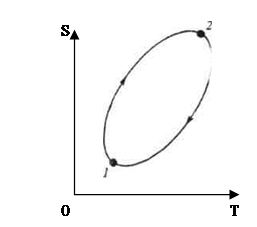 |
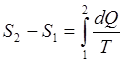 (7)
(7)
(рис. 1)
Если обратимый процесс характеризуется замкнутым циклом, то очевидно изменение энтропии и контурный интеграл от приведенной теплоты в этом случае равны нулю (рис.1):
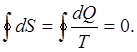 (8)
(8)
Для адиабатного обратимого процесса приведенная теплота равна нулю, а энтропия остается постоянной. Однако если процесс протекает необратимо, то энтропия, как было выяснено ранее, возрастает, т.е. для адиабатного необратимого процесса ![]() (9).
(9).
Изменение энтропии при необратимых адиабатных процессах наводит на мысль использовать эту величину для характеристики необратимости любых процессов в макросистемах. Причем за меру необратимости удобно принять разность между dS и ![]() , которая равна нулю для обратимых процессов и больше нуля для необратимых.
, которая равна нулю для обратимых процессов и больше нуля для необратимых.
Используя это соображение, можно утверждать, что все процессы в макросистемах протекают таким образом, что
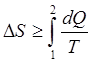 (10)
(10)
Если процесс круговой, то
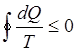 (11)
(11)
причем знак неравенства относится к неравновесным процессам, а равенство характеризует равновесные процессы.
Таким образом, энтропия действительно является такой функцией состояния, применение которой позволяет определить направленность протекания реальных процессов в макросистемах. Второе начало термодинамики выражает это утверждение в форме постулата.
5. Второе начало термодинамики
Второе начало термодинамики - один из принципов термодинамики, постулирует существование еще одной функции состояния - энтропии и определяет характер ее изменения в обратимых и необратимых процессах, утверждая, что изменение энтропии в макросистемах больше или равно изменению приведенной теплоты для неравновесных и равновесных процессов соответственно.
Математическим выражением второго начала термодинамики является соотношение между элементарным изменением энтропии и приведенной теплотой:
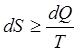 . (12)
. (12)
Воспользуемся первым началом термодинамики и выразим в выражении (12) количество теплоты dQ через изменение внутренней энергии dE и элементарную работу dA.
Получим:
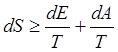 (13)
(13)
Знак равенства в выражении (13) соответствует обратимым процессам, неравенство характеризует изменение энтропии в неравновесных процессах. Таким образом, для равновесных процессов из выражения (13) имеем равенство:
Другие рефераты на тему «Экология и охрана природы»:
Поиск рефератов
Последние рефераты раздела
- Влияние Чекмагушевского молочного завода на загрязнение вод реки Чебекей
- Влияние антропогенного фактора на загрязнение реки Ляля
- Киотский протокол - как механизм регулирования глобальных экологических проблем на международном уровне
- Лицензирование природопользования, деятельности в области охраны окружающей среды и обеспечения экологической безопасности
- Мировые тенденции развития ядерной технологии
- Негативные изменения состояния водного бассейна крупного города под влиянием деятельности человека
- Общественная экологическая экспертиза и экологический контроль
